Равновесие
А. Реакции переноса
групп
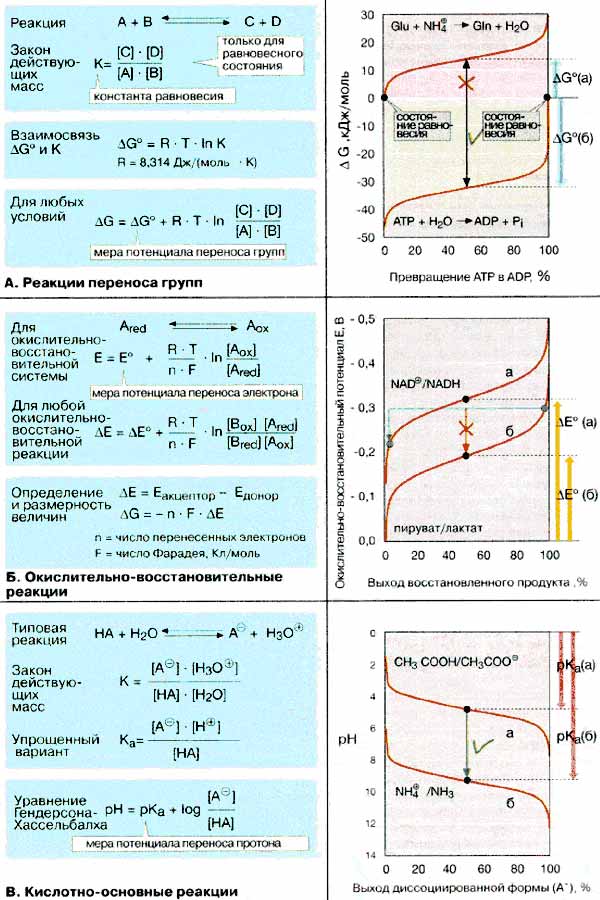
Каждая химическая реакции по истечении некоторого времени достигает
состояния равновесия, при котором прямая и обратная реакции идут с равными
скоростями. Соотношение концентраций исходных веществ (А, В) и конечных продуктов
(С, D) в равновесном состоянии описываются законом действующих масс.
Константа равновесия К непосредственно связана с изменением свободной
энергии реакции в стандартных условиях ΔG° (ΔG° = -RT ln К) Уравнение
действительно для любых концентраций веществ. Если ΔG < 0, реакция
протекает спонтанно до тех пор. пока не будет достигнуто равновесие (т. е. до
ΔG° = 0). При ΔG > 0 реакция не может протекать спонтанно (эндергонический
процесс, см. с. 22). В биохимии ΔG обычно относят
к pH 7 и обозначают как ΔG0 ' или ΔG '.
В качестве примера на схеме приводятся две реакции переноса
групп. Перенос фосфатных групп от аденозинтрифосфата [АТФ (АТР)] к воде — высокоэкзергонический
процесс [реакция а]. Равновесие наступает лишь
при гидролизе более 99,9% исходного АТФ (см. с. 124).
АТФ и родственные соединения являются высокоэффективными переносчиками
фосфатных групп. Количественно это свойство выражается величинами свободной
энергии реакции гидролиза ΔG° (см. с. 124).
Напротив, эндергонический процесс — перенос аммиака
(NH3) на глутамат [GIu, реакция б] —
достигает равновесия настолько быстро, что за это время успевает образоваться
минимальное количество глутамина. Поэтому синтез глутамина из названных предшественников
возможен лишь при сопряжении с экзергонической реакцией (см. с. 22,
126).
Б. Окислительно-восстановительные реакции
Реакции переноса электронов (см. с. 20)
также протекают в соответствии с законом действующих масс. Для отдельной
окислительно - восстановительной системы
(редокс-системы) справедливо уравнение Нернста (см. с. 38). Потенциал
переноса электронов такой системы (т.е. склонность системы отдавать и
принимать электроны) определяется ее окислительно-восстановительным
потенциалом в стандартных условиях (стандартным восстановительным
потенциалом E° и соответственно Е°' при pH 7). При описании
реакций между двумя редокс-системaми вместо ΔG обычно используют разность
потенциалов двух систем (ΔΕ). ΔΕ и ΔG связаны простым соотношением, но имеют
противоположные знаки. Окислительно-восстановительная реакция протекает
спонтанно, если ΔΕ > 0.
В правой части схемы представлена зависимость потенциала E
от соотношения реагентов (приведена доля восстановленной формы в процентах)
для двух важных в биохимическом отношении систем (пируват/лактат и НАД+/HАДH
(NAD+/NADH) см. рис. 103). В стандартных условиях
(обе системы восстановлены на 50%) перенос электрона с лактата на НАД+
невозможен, поскольку ΔΕ — величина отрицательная (-0,13 В, красная
стрелка). Но перенос имеет место в том случае, если система пируват/лактат восстановлена
на 98%, а система НАД+/HАДH окислена на 98% (зеленая стрелка, ΔΕ
= +0,08 B).
В. Кислотно-основные
реакции
В реакциях переноса протона всегда принимает участие пара сопряженных
кислот и оснований (см. с. 36). Степень диссоциации
кислотно-основной пары зависит от концентрации H+. Чаще всего приводится
не собственно концентрация протонов, а ее отрицательный логарифм, величина
pH. Взаимосвязь между pH и константой диссоциации описывается уравнением
Гендерсона-Хассельбалха. В качестве меры химического потенциала переноса
протона кислотно-основной пары служит величина рКа — отрицательный
логарифм константы диссоциации кислоты Ка. Чем сильнее кислота, тем
меньше ее рКа. Кислоты с небольшими pKа могут
протонировать основания с высокими рКа(зеленая стрелка).


