Апоптоз
А. Пролиферация клеток и
апоптоз
Количество клеток в ткани регулируется
двумя процессами — пролиферацией клеток и "программированной, или
физиологической, гибелью клеток" (апоптозом). Оба процесса в
организме находятся под контролем стимулирующих или ингибирующих факторов,
которые присутствуют в растворимой форме или экспрессируются на поверхности
соседних клеток.
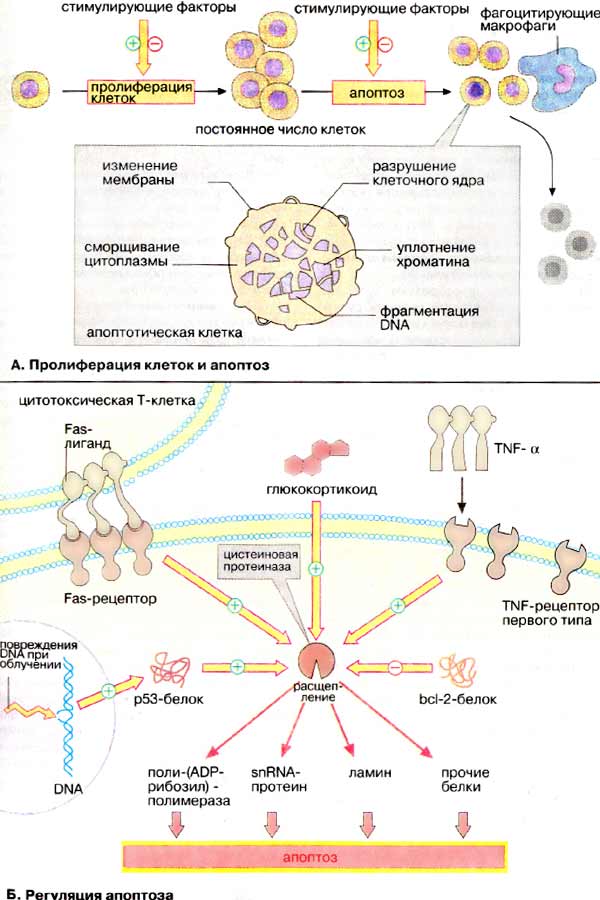
Апоптоз — генетически
запрограммированная гибель клеток, которая приводит к "аккуратной" разборке и
удалению клеток. Морфологическими признаками этого активного процесса являются
изменения клеточной мембраны ("отшнуровывание" пузырьков, так называемых
апоптотических телец), распад клеточного ядра, уплотнение хроматина и
фрагментация ДНК. Клетки, подвергшиеся апоптозу, распознаются макрофагами
и другими фагоцитирующими клетками и быстро элиминируются Очень важно то, что
при апоптозе не развивается воспалительный процесс. Другой вид гибели клеток,
некроз, отличается от апоптоза тем, что он развивается в результате
повреждения клеточной мембраны химическими агентами или физическими
факторами. При некрозе поврежденные клетки набухают, а затем лизируются; при
этом часто развивается воспалительный процесс. С помощью апоптоза осуществляется
регуляция объема или, точнее, количества клеток в той или иной ткани. В
особенности это касается быстро пролиферирующих клеток, таких, как клетки
кроветворной системы или гепатоциты печени. Посредством апоптоза организм
избавляется от ненужных, или «отработавших», клеток, например во время
эмбрионального развития, при формировании нервной системы и при иммунном ответе.
Путем апоптоза элиминируются трансформированные клетки, например при
канцерогенной дегенерации, вирусной инфекции или необратимом повреждении ДНК в
случае облучения. Примером апоптоза является шелушение кожи при солнечном
загаре.
Б. Регуляция
апоптоза
Апоптоз запускается внешними сигналами,
которые используют различные сигнальные пути, большинство этих путей
действительно запускают апоптоз, однако некоторые пути его
блокируют.
Фактор некроза опухолей [α-ФНО (TNFα),
см. рис. 379] связывается с ФНО-рецептором первого типа и запускает апоптоз.
Центральное место в регуляции апоптоза принадлежит цистеиновым протеиназам (см.
с. 178), родственным интерлейкин-1β-конвертазе (ИК). Предполагают, что
активация этих протеиназ через ФНО-рецептор происходит как многоступенчатый
процесс белок-белкового взаимодействия. ИК-подобные протеиназы специфическим
образом расщепляют поли-(АДФ-рибозил)-полимеразу (ПАРП), белки
sn-рибонуклеопротеидного комплекса, ламин (белок ядерной мембраны) и другие
белки. Эти измененные за счет протеолиза белки запускают процесс
апоптоза.
По аналогичному пути реализуется сигнал
от Fas-лиганда, белка клеточной мембраны соседних клеток. Fas-лиганд в
виде тримера связывается с Fas-рецептором. Затем, по аналогии с
ФНО-рецептором, сигнал передается на цистеиновые протеиназы. Для ФНО- и
Fas-специфичных рецепторов характерно, что они активируются путем образования
олигомеров.
Источником сигнала может быть и
клеточное ядро. Так, белок р53, продукт онко-супрессорного гена
(см. рис. 385), который тоже активирует цистеиновые протеиназы, может быть
активирован посредством нерепарабельного разрыва ДНК (DNA). Утрата клеткой белка
p53 ведет к повышенной скорости роста опухоли.
Сигналам, которые активируют апоптоз,
противостоят другие сигналы, блокирующие апоптоз. Таким сигналом может быть
белок bcl-2 или родственные белки Ген этого белка присутствует в геноме
некоторых вирусов. С помощью продукта этого гена вирусы препятствуют
преждевременной гибели клетки-хозяина посредством
апоптоза.


