Первичная структура белка
К настоящему времени расшифрована первичная структура десятков тысяч разных белков, что является несомненным достижением биохимии. Однако это число ничтожно мало, если учесть, что в природе около 1012 разнообразных белков. Под первичной структурой подразумевают порядок, последовательность расположения аминокислотных остатков в полипептидной цепи. Зная первичную структуру, местоположение каждого остатка аминокислоты, можно точно написать структурную формулу белковой молекулы, если она представлена одной полипептидной цепью. Если в состав белка входит несколько полипептидных цепей, объединенных в одну белковую молекулу посредством дисульфидных связей и нековалент-ных взаимодействий, или если одна полипептидная цепь содержит внутренние дисульфидные связи, то задача определения первичной структуры несколько осложняется, так как необходимо предварительное разъединение этих цепей и связей. Разъединение таких полипептидных цепей производят с помощью денатурирующих агентов (растворы 8М мочевины или 6М гуанидингидрохлорида), разрывающих нековалентные связи. Дисульфид-ные связи разрушают путем окисления или восстановления (надмуравьиной кислотой или β-меркаптоэтанолом соответственно), при этом образуются свободные полипептиды, содержащие или остатки цистеиновой кислоты, или цистеина:
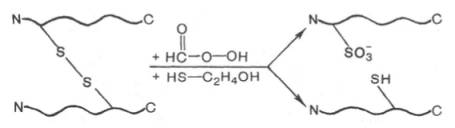
Для определения первичной структуры отдельной, химически гомогенной полипептидной цепи в первую очередь методами гидролиза выясняют аминокислотный состав, точнее, соотношение каждой из 20 аминокислот в образце гомогенного полипептида. Затем приступают к определению химической природы концевых аминокислот полипептидной цепи, содержащей одну свободную NH2-группу и одну свободную СООН-группу.
Предыдущая страница |
Следующая страница
СОДЕРЖАНИЕ