2.2. Межфазовое натяжение.
Определение понятий «адгезия» и «когезия»
В отличие от поверхности раздела «жидкость – газ», когда межмолекулярным взаимодействием молекул поверхностного слоя с молекулами газовой фазы можно пренебречь в связи с ее низкой плотностью, величина межфазового натяжения на границе двух жидкостей определяется по существу разницей межмолекулярных взаимодействий молекул поверхностного слоя с молекулами обеих фаз. Поскольку абсолютно нерастворимых друг в друге жидкостей практически нет, то по существу в равновесии будут находиться два насыщенных раствора.
Для экспериментального определения межфазового натяжения можно использовать некоторые из методов, описанных ранее для поверхностного натяжения, в частности, метод сталагмометра, метод вращающейся капли.
Находит также применение метод наибольшего давления в капле одной жидкости, выдавливаемой в другую. При экспериментальном определении межфазового натяжения следует обязательно использовать такие методы, которые позволяют осуществлять процесс формирования новой поверхности со скоростью, достаточной для насыщения одной жидкости другою, и наоборот. Или проводить такое насыщение жидкостей предварительно. Этим условием в наибольшей степени отвечает метод вращающейся капли.
В том случае, если одна жидкость хорошо смачивает другую, расчет межфазового натяжения можно проводить по эмпирическому правилу Антонова:
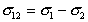 , (1.2.25)
, (1.2.25)
где s12 , s1, s2 – поверхностное натяжение на границе двух жидкостей и этих жидкостей на границе с собственным паром.
Это правило приблизительно соблюдается для многих систем, но известно и много исключений. Связано это с определенной ориентацией молекул на поверхности раздела фаз (например, с собственным паром), которая может изменяться на границе двух жидкостей, а также в результате присутствия даже ничтожных количеств третьего компонента, способного к изменению межфазного натяжения.
Гаркинс рассмотрел работу адгезии между двумя фазами и связал ее с ориентацией молекул на поверхности раздела фаз. Адгезия по физическому смыслу – явление, близкое к явлению адсорбции, когда две взаимно нерастворимые жидкости, или жидкость и твердое тело, или, наконец, два твердых тела приводятся в тесный контакт друг с другом и под действием межмолекулярных сил притяжения (дисперсионных, полярных или электрических) прочно прилипают друг к другу так, что для их разделения надо приложить определенное усилие или произвести работу.
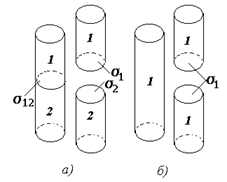
На рис. 1.21 приведена схема разделения двух конденсированных тел (жидких или твердых) (а) и одного сплошного тела на два (б).
Работа адгезии определяется выражением
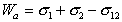 . (1.2.26)
. (1.2.26)
Как показано на рис. 1.21, Wа характеризует работу, необходимую для разделения единицы межфазовой поверхности между двумя конденсированными телами на две поверхности этих тел на границе с собственным паром.
Аналогичная работа разделения одного тела на два, называемая работой когезии (см. рис. 1.21 б), составит
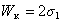 . (1.2.27)
. (1.2.27)
В табл. 1.2 приведены значения работы адгезии некоторых жидкостей к воде. Из данных этой таблицы следует, что многие неполярные органические жидкости имеют значения работы адгезии к воде, близкие к значениям работы когезии. Это дает возможность предполагать, что поверхности раздела этих жидкостей на границе с водой сходны по своей природе и образованы преимущественно углеводородными группировками. Углеводородные жидкости, имеющие в структуре молекул полярные группы, характеризуются высокими значениями работы адгезии, поэтому можно полагать, что полярные группы этих молекул ориентированы в сторону воды.
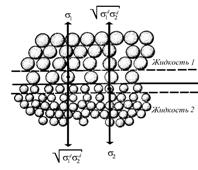
На рис. 1.22 показана модель поверхностного слоя между двумя жидкостями, предложенная Гудом и Фоуксом для расчета межфазового натяжения.
Из уравнения (1.2.26) для межфазового натяжения двух жидкостей следует
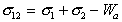 . (1.2.28)
. (1.2.28)
Рис. 1.22. Схема межфазового слоя по модели Гуда – Фоукса |
Видно, что это уравнение отличается от выражения, обычно используемого для расчетов правила Антонова.
Трудность для практического применения уравнения (1.2.28) состоит в сложности теоретического расчета работы адгезии. Поэтому были предложены различные уравнения для расчета межфазового натяжения, не включающие в себя работу адгезии. Если две контактирующие фазы взаимно нерастворимы и их взаимодействие определяется только силами Ван-дер-Ваальса, а постоянные взаимодействия подчиняются правилу среднего геометрического, тогда для межфазной свободной энергии и работы адгезии оказываются справедливыми уравнения Джирифалько и Гуда:
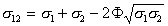 , (1.2.29)
, (1.2.29)
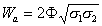 , (1.2.30)
, (1.2.30)
где Ф – параметр взаимодействия контактирующих фаз.
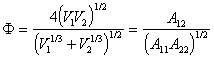 , (1.2.31)
, (1.2.31)
где V1, V2 – мольные объемы фаз; А11 , А22 – их постоянные межмолекулярных сил взаимодействия (Гамакера).
Для различных пар контактирующих фаз параметрФ изменяется в пределах от 0,5 до 1,2. Если взаимодействуют фазы, имеющие равные мольные объемы и близкие значения постоянных А, то Ф =1, поэтому
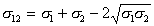 . (1.2.32)
. (1.2.32)
Если взаимодействие между контактирующими фазами происходит исключительно за счет дисперсионных сил, то Ф = 1.
Межфазовое натяжение определяется не только дисперсионными силами взаимодействия, но и полярными (дипольными, водородной связью и т.д.) только в том случае, если обе фазы полярны. Если обе фазы неполярны, или хотя бы одна из них неполярна, то водородные связи и дипольные взаимодействия не играют существенной роли.
Рассматривая поверхностную энергию как сумму инкрементов отдельных взаимодействий, Фоукс предложил уравнение
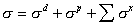 , (1.2.33)
, (1.2.33)
где индексы d, p- обозначают эффективные поверхностные натяжения, обусловленные дисперсионным и полярным взаимодействием; x- остальная часть поверхностного натяжения, обусловленного, например, металлической связью и т.д.
Учитывая (1.2.33), уравнение (1.2.32) можно переписать в виде
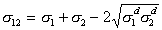 . (1.2.34)
. (1.2.34)
Если предполагать, что дисперсионная часть s d не зависит от природы второй контактирующей фазы, то можно расчленить si на инкременты и рассчитать s d для любых жидкостей.
Далее, поскольку s d отождествляется с дисперсионным взаимодействием, следовательно, позволяет рассчитать постоянные Гамакера. Для одинаковых взаимодействующих тел эта зависимость выражается приведенным ранее уравнением (1.2.23), для различных тел используется уравнение
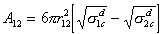 , (1.2.35)
, (1.2.35)
где r12- радиус сил Ван-дер-Ваальса (r12» 0,2 нм).
Из уравнения (1.2.35) следует, что взаимодействие двух контактирующих фаз будет усиливаться при увеличении разности поверхностных натяжений.
На основе модели Джирифалько и Гуда более общее выражение для разделения поверхностного натяжения на инкременты дал Ву. Уравнение Ву, ограниченное случаем межфазовой поверхности органических жидкостей, имеет вид
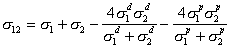 . (1.2.36)
. (1.2.36)
Это уравнение переходит в уравнение Джирифалько и Гуда (1.2.29), в котором
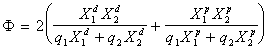 , (1.2.37)
, (1.2.37)
где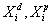 - доля неполярного и полярного вкладов каждой из контактирующих фаз в межфазное натяжение; q1, q2 – отношения поверхностных натяжений.
- доля неполярного и полярного вкладов каждой из контактирующих фаз в межфазное натяжение; q1, q2 – отношения поверхностных натяжений.
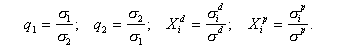
Ву измерил поверхностное натяжение ряда углеводородов в жидком и твердом состоянии и вычислил полярные вклады s p и Xp из данных по поверхностному натяжению полярных-неполярных пар, используя уравнение (1.2.36).
При этом в качестве неполярного твердого вещества он выбрал полиэтилен, у которого s p= 0, тогда полярный член в уравнении (1.2.36) исчезал и  полярной фазы можно было рассчитать из измеренных значений s12, s1 и s2. Полярную часть поверхностного натяжения рассчитывают по разности между s и s d. Установлено, что метод Ву позволяет получить наиболее корректные значения полярного и дисперсионного инкрементов поверхностного натяжения и рассчитать соответствующую работу адгезии, так как
полярной фазы можно было рассчитать из измеренных значений s12, s1 и s2. Полярную часть поверхностного натяжения рассчитывают по разности между s и s d. Установлено, что метод Ву позволяет получить наиболее корректные значения полярного и дисперсионного инкрементов поверхностного натяжения и рассчитать соответствующую работу адгезии, так как
 . (1.2.38)
. (1.2.38)
Для двух фаз с близкими значениями поляризуемости дисперсионный вклад в работу адгезии рассчитывают по уравнению
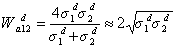 , (1.2.39)
, (1.2.39)
а полярный инкремент работы адгезии - по уравнению
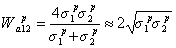 . (1.2.40)
. (1.2.40)
Зная соответствующие инкременты, можно рассчитать работу адгезии любых контактирующих тел. Целенаправленную химическую и физическую модификацию полимерных волокнообразующих материалов можно проводить для уменьшения дисперсионной и особенно полярной компонент поверхностного натяжения и адгезии.