7.2. Фотодиссоциация
Солнце испускает энергию с разной длиной волны. Коротковолновое излучение в ультрафиолетовой области спектра обладает высокой энергией, вызывающей химические реакции. При этом энергия фотона (Е = hn) должна быть достаточна для разрыва химической связи в молекуле и инициирования процесса. Кроме того, молекулы должны поглощать фотон, энергия которого должна превращаться в какую-либо иную форму. Первая реакция - фотодиссоциация кислорода:
О2 (г) + hn® 2 О (г) . (1)
Максимальная энергия, которая необходима для такого превращения, равна 495 кДж/моль. Можно выполнить нетрудный расчет (см. ниже задачу) и определить, каковы должны быть n и l этого излучения. l равна 242 нм. Значит, любой фотон с длиной волны менее 242 нм имеет достаточную энергию для этой реакции (чем короче l, тем выше энергия).
Задача. Какая длина волны фотона соответствует молярной энергии диссоциации связи 495 кДж/моль?
Решение. Сначала вычислим энергию, необходимую для разрыва связи в одной молекуле.
Е` = 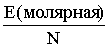 =
= 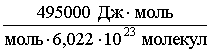 = 8,22·10–19
= 8,22·10–19 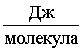 .
.
Найдем частоту колебания, зная, что энергия фотона Е = hn; n = 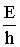 = =
= = 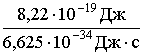 = 1,24·1015 с-1.
= 1,24·1015 с-1.
Вспомним, что произведение частоты и длины волны электромагнитного излучения равно скорости света: n·l = с = 3,00·108 м/с; l =  = =
= = 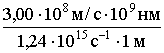 = 242 нм.
= 242 нм.
К нашему счастью, молекулы О2 поглощают большую часть коротковолнового излучения с высокой энергией, прежде чем оно достигнет нижней части атмосферы. При этом образуется атомарный кислород. На высотах около 400 км диссоциировано 99% молекул кислорода, на долю молекул О2 приходится лишь 1%. На высоте 130 км содержание О2 и О одинаково. На меньших высотах содержание молекулярного кислорода больше такового атомарного.
Энергия диссоциации молекулы N2 очень велика, значит, разорвать молекулу могут только фотоны с чрезвычайно высокой энергией и очень малой l. Таких фотонов немного, да и молекула азота плохо поглощает фотоны, даже если их энергия окажется достаточной. Вследствие этого атомарного азота очень мало.
Фотодиссоциация воды. Концентрация паров воды значительна вблизи поверхности Земли, но быстро уменьшается с высотой. На высоте 30 км (стратосфера) составляет три молекулы на миллион молекул смеси. Однако, оказавшись в верхних слоях, вода подвергается фотодиссоциации:
Н2О (г) + hn® Н (г) + ОН (г); (2)
ОН (г) + hn® Н (г) + О (г). (3)
Фотодиссоциация (уравнения 1-3) осуществляется через процесс ионизации. В 1924 году было установлено, что в верхних слоях атмосферы имеются свободные электроны, а по закону баланса зарядов должны быть и положительно заряженные ионы. Откуда же берутся эти ионы? В меньшей мере от воздействия электронов, прилетающих от Солнца вместе с солнечным ветром, а в большей мере - вследствие фотодиссоциации. При воздействии фотона молекула может поглотить его, не расщепляясь на атомы. При этом фотон выбивает из молекулы электрон самого верхнего уровня, и образуется молекулярный ион. Таким же образом может подвергнуться ионизации и нейтральный атом.
Фотоны, вызывающие ионизацию, относятся к высокочастотной коротковолновой области в пределах ультрафиолета. Это излучение не доходит до поверхности Земли, его поглощают верхние слои атмосферы (табл. 7.2).
Таблица 7.2
Реакции, происходящие в верхних слоях атмосферы
Уравнение реакции | – DН ионизации кДж/моль | lmax, нм |
N2 + hn® N2+ + e | 1495 | 80,1 |
O2 + hn® O2+ + e | 1205 | 99,3 |
O + hn® O+ + e | 1313 | 91,2 |
NO + hn® NO+ + e | 890 | 134,5 |
Необходимо обратить внимание на то, что все данные реакции экзотермические.