ДИСУЛЬФИДЫ ОРГАНИЧЕСКИЕ (диорганилдисульфиды), содержат в молекуле два связанных друг с другом атома серы. Орг. дисульфиды можно рассматривать как производные дисульфана H2S2. Различают ациклич. (ф-ла I), моноциклич. (II) и полициклич. дисульфиды (напр., III).
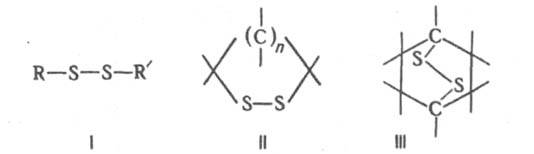
Алифатич. дисульфиды типа I наз. также дитиаалканами, типа II -1,2-дитиациклоалканами, III - эпидитиациклоалканами. Наиб. практич. значение имеют дисульфиды типа I. Алифатич. соед. этой группы - высококипящие дурнопахнущие маслянистые жидкости, сильно преломляющие свет; ароматич. соед. -кристаллы. Длина связи S—S ок. 0,2 нм, барьер вращения вокруг этой связи до 67 кДж/моль, угол CSS ок. 103°, двугранный (диэдральный) угол CS—SC 80-100°. Энергия диссоциации дисульфидной связи ок. 293 кДж/моль, максимум поглощения - в области длин волн 245-325 нм, частота валентных колебаний - в интервале 500-800 см-1. Дисульфиды типа I не раств. в воде, хорошо раств. в орг. р-рителях.
Хим. св-ва дисульфидов определяются низкой прочностью дисульфидной связи. Мн. восстановители, напр. NaHSO3, гидриды металлов, атомарный Н, легко восстанавливают дисульфиды до тиолов. Восстановит. расщепление связи S—S вызывают также горячая вода под давлением, ОН- (особенно легко -в присут. солей тяжелых металлов) и CN- , монотиофосфорная к-та, третичные фосфины, нек-рые тиолы, тио- и дитиогликоли. В кислых средах дисульфиды восстанавливаются на ртутном катоде при потенциале до — 2 В. Триалкилфосфиты десульфируют дисульфиды до моносульфидов. Дисульфиды окисляются пероксидами или пероксокислотами до сульфокислот RSO3H, сульфиновых к-т RSO2H, тиосульфинатов RS(O)SR', тиосульфатов RSO2SR', a-дисульфонов RSO2SO2R'. При УФ облучении дисульфиды образуют тиильные радикалы RS*.
Дисульфиды легко взаимод. с Сl2, Вr2 и сульфурилгалогенидами по схеме:
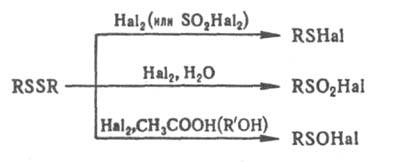
R - алкил, арил, алкенил, алкинил, аралкил, гетерил; R' - алкил. Дисульфиды получают: окислением тиолов, напр. О2, I2, Н2О2; р-цией алкилгалогенидов или солей диазония с Na2S2; щелочным гидролизом (в присут. О2 или I2) солей изотиурония RSC(=NH)NH2.HHal, ксантогенатов ROC(S)SNa и солей Бунте RSSO3M; взаимод. диалкил- и диарилсульфидов с серой и др. способами. Ряд ароматич. дисульфидов типа I получают сплавлением анилина или его производных с серой, из S2Cl2 и ароматич. соед. по р-ции Фриделя-Крафтса. Для анализа дисульфидов их предварительно восстанавливают до тиолов; для качеств. обнаружения используют р-цию тиолов с нитропруссидом Na. Определяют дисульфиды амперометрич. титрованием р-рами AgNO3, HgCl2 или ртутьорг. соединений. Наиб. чувствительный метод - флуорометрический при помощи меркуриацетата флуоресцеина. Дисульфиды используют для получения пестицидов, мед. препаратов, красителей, в орг. синтезе. Дисульфидные связи содержатся в молекулах мн. белков, нек-рых прир. низкомолекулярных биологически активных соед. (напр., в цистине, липоевой к-те). К прир. дисульфидам типа III относятся спородесмины и нек-рые антибиотики. Дисульфиды средне- или малотоксичны для теплокровных. В ряду дисульфидов типа I токсичность снижается с увеличением мол. массы. См. Диметилдисульфид, Дшпианы, Дитиоланы, Тетурам.
===
Исп. литература для статьи «ДИСУЛЬФИДЫ ОРГАНИЧЕСКИЕ»: Оаэ Сигэру, Химия органических соединения серы, пер. с япон., М., 1975; Торчинский Ю. М., Сера в белках, М., 1977; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 445-59. А. Ф. Коломиец, Н. Д. Чкаников.

Алифатич. дисульфиды типа I наз. также дитиаалканами, типа II -1,2-дитиациклоалканами, III - эпидитиациклоалканами. Наиб. практич. значение имеют дисульфиды типа I. Алифатич. соед. этой группы - высококипящие дурнопахнущие маслянистые жидкости, сильно преломляющие свет; ароматич. соед. -кристаллы. Длина связи S—S ок. 0,2 нм, барьер вращения вокруг этой связи до 67 кДж/моль, угол CSS ок. 103°, двугранный (диэдральный) угол CS—SC 80-100°. Энергия диссоциации дисульфидной связи ок. 293 кДж/моль, максимум поглощения - в области длин волн 245-325 нм, частота валентных колебаний - в интервале 500-800 см-1. Дисульфиды типа I не раств. в воде, хорошо раств. в орг. р-рителях.

R - алкил, арил, алкенил, алкинил, аралкил, гетерил; R' - алкил. Дисульфиды получают: окислением тиолов, напр. О2, I2, Н2О2; р-цией алкилгалогенидов или солей диазония с Na2S2; щелочным гидролизом (в присут. О2 или I2) солей изотиурония RSC(=NH)NH2.HHal, ксантогенатов ROC(S)SNa и солей Бунте RSSO3M; взаимод. диалкил- и диарилсульфидов с серой и др. способами. Ряд ароматич. дисульфидов типа I получают сплавлением анилина или его производных с серой, из S2Cl2 и ароматич. соед. по р-ции Фриделя-Крафтса. Для анализа дисульфидов их предварительно восстанавливают до тиолов; для качеств. обнаружения используют р-цию тиолов с нитропруссидом Na. Определяют дисульфиды амперометрич. титрованием р-рами AgNO3, HgCl2 или ртутьорг. соединений. Наиб. чувствительный метод - флуорометрический при помощи меркуриацетата флуоресцеина. Дисульфиды используют для получения пестицидов, мед. препаратов, красителей, в орг. синтезе. Дисульфидные связи содержатся в молекулах мн. белков, нек-рых прир. низкомолекулярных биологически активных соед. (напр., в цистине, липоевой к-те). К прир. дисульфидам типа III относятся спородесмины и нек-рые антибиотики. Дисульфиды средне- или малотоксичны для теплокровных. В ряду дисульфидов типа I токсичность снижается с увеличением мол. массы. См. Диметилдисульфид, Дшпианы, Дитиоланы, Тетурам.
===
Исп. литература для статьи «ДИСУЛЬФИДЫ ОРГАНИЧЕСКИЕ»: Оаэ Сигэру, Химия органических соединения серы, пер. с япон., М., 1975; Торчинский Ю. М., Сера в белках, М., 1977; Общая органическая химия, пер. с англ., т. 5, М., 1983, с. 445-59. А. Ф. Коломиец, Н. Д. Чкаников.
Страница «ДИСУЛЬФИДЫ ОРГАНИЧЕСКИЕ» подготовлена по материалам химической энциклопедии.
Активные темы форума