СЕЛЕН (от греч.
selene-Луна; лат. Selenium), Se, хим. элемент VI гр. периодич. системы, относится
к халькогенам; ат. н. 34, ат. м. 78,96. Природный селен состоит из шести
изотопов: 74Se (0,87%), 76Se (9,02%), 77Se
(7,58%), 78Se (23,52%), 80Se (49,82%) и 82Se(9,19%).
Поперечное сечение захвата тепловых нейтронов для прир. смеси 12,3·10-28
м2. Конфигурация внеш. электронной оболочки атома 4s24р4;
степени окисления —2, +4 и +6, редко +2; энергии ионизации при последоват.
переходе от Se0 к Sе6+ равны 9,752, 21,2, 32,0, 42,9,
68,3, 81,7 эВ; сродство к электрону 2,020 эВ; электроотрицательность по Полингу
2,40; атомный радиус 0,160 нм, ионные радиусы (нм, в скобках даны координац.
числа) Se2- 0,184 (6), Se4+ 0,064 (6), Se6+
0,042 (4), 0,056 (6).
Среднее содержание в Земной
коре 1,4·10-5% по массе, в воде морей и океанов 4·10-3мг/л.
Известно более 50 минералов селена, напр. берцелианит Cu2Se, науманнит
Ag2Se, самородный Se, халькоменит CuSeO3 · 2 Н2О.
Содержание селена в пирите, галените, висмутине и др. сульфидах, а также в вулканич.
сере до неск. %. Извлекают его в осн. из медных, пиритных, свинцовых, никелевых
и др. руд, где он находится в рассеянном состоянии.
Свойства. При атм.
давлении существует ряд модификаций селена. Наиб. стабилен серый селен (g-Se, "металлический"
селен) с гексагон. кристаллич. решеткой, а = 0,436388 нм, с = 0,495935
нм, z = 3, пространств. группа C312. Его получают из
др. форм при их длит. нагревании, медленном охлаждении расплава, конденсацией
паров и т. д. Структура серого Se состоит из параллельных спиральных цепей.
Из р-ров в CS2 получены три моноклинные модификации красного селена:
a-Se - оранжево-красный, а = 0,9054 нм, b = 0,9083 нм, с
= 1,1601 нм, b = 90,81 °, z = 32, пространств. группа Р21/п,
т.пл. 170°С, плотн. 4,46 г/см3; b-Se-тем-но-красный,
а = 1,285 нм, b = 0,807 нм, с = 0,931 нм, b = = 93,13°,
z = 32, пространств. группа Р21/а, т.пл.
180 °С, плотн. 4,50 г/см3; для красного g-Se-a =
1,5018 нм, b = 1,4713 нм, с = 0,8789 нм, b = 93,61°,
z = 64, пространств. группа Р21/с, плотн.
4,33 г/см3. Эти три формы содержат кольцевые молекулы Se8
в форме короны.
Быстрым охлаждением расплава
получают стекловидный черный селен-хрупкое в-во со стеклянным блеском от красно-коричневого
до голубовато-черного цвета, плотн. 4,28
г/см3. Содержит в осн., как и жидкий селен, плоские зигзагообразные
цепочечные молекулы. Аморфный красный селен может быть получен, напр., восстановлением
H2SeO3 на холоду. Это тонкий порошок, плотн. 4,26 г/см3,
от ярко-красного до красновато-черного цвета. Имеет цепочечную структуру.
При давлении 27 МПа получена
кубич. модификация селена, а = 0,2982 нм. Моноклинный и аморфный селен при 1012
МПа образуют метастабильную гексагон. металлич. фазу.
Для серого g-Sе:т.
пл. 221 °С, т. кип. 685 °С; плотн. 4,807 г/см3, плотн. жидкого
4,06 г/см3 (221 °С); 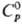 25,4
Дж/(моль·К);
25,4
Дж/(моль·К);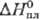 6,20
кДж/моль,29
6,20
кДж/моль,29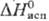 кДж/моль;
кДж/моль;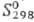 42,1 ДжДмоль·К); ур-ния
температурной зависимости давления пара: над твердым селеном lgp (гПа) = 13,7029-7644/T,
над жидким lgp(гПа) = 8,2354-5011/T, теплопроводность 0,5 Вт/(м·К);
температурный коэф. линейного расширения 25,5·10-6 К-1
(273 К); r8,0·102 Ом·м, температурный коэф. r0,6·10-3
К-1 (298-398 К); полупроводник с дырочной проводимостью, ширина запрещенной
зоны 1,8 эВ; диамагнитен, магн. восприимчивость — 0,469·10-9. Для
стекловидного селена r 1010 Ом·м. Твердость по Моосу серого селена 2,0,
по Бринеллю ~750 МПа, модуль нормальной упругости 10,2 ГПа. Селен хрупок, выше
60 °С становится пластичным.
42,1 ДжДмоль·К); ур-ния
температурной зависимости давления пара: над твердым селеном lgp (гПа) = 13,7029-7644/T,
над жидким lgp(гПа) = 8,2354-5011/T, теплопроводность 0,5 Вт/(м·К);
температурный коэф. линейного расширения 25,5·10-6 К-1
(273 К); r8,0·102 Ом·м, температурный коэф. r0,6·10-3
К-1 (298-398 К); полупроводник с дырочной проводимостью, ширина запрещенной
зоны 1,8 эВ; диамагнитен, магн. восприимчивость — 0,469·10-9. Для
стекловидного селена r 1010 Ом·м. Твердость по Моосу серого селена 2,0,
по Бринеллю ~750 МПа, модуль нормальной упругости 10,2 ГПа. Селен хрупок, выше
60 °С становится пластичным.
Селен, особенно аморфный и
мелкодисперсный, активен химически. При нагр. на воздухе горит (цвет пламени-голубой)
с образованием SeO2 (см. Селена оксиды). С F2,
C12 и Вr2 реагирует при комнатной т-ре. Сплавляется с
I2, но иодиды при этом не образуются. Выше 200°С реагирует с
Н2, давая H2Se. При нагр. образует соед. со всеми металлами
(см. Селениды). С водой реагирует при нагр.: 3Se + 3H2O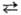 2H2Se
+ H2SeO3. Соляная и разб. серная к-ты с селеном не взаимодействуют.
В конц. H2SO4 селен раств. на холоду, давая зеленый р-р,
содержащий полимерные катионы
2H2Se
+ H2SeO3. Соляная и разб. серная к-ты с селеном не взаимодействуют.
В конц. H2SO4 селен раств. на холоду, давая зеленый р-р,
содержащий полимерные катионы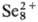 ,
к-рый при хранении переходит в желтый р-р с катионами
,
к-рый при хранении переходит в желтый р-р с катионами 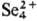 . В HNO3 при нагревании селен окисляется до H2SeO3,
в конц. р-рах щелочей раств. с образованием селенида и селената(IV), в присут.
О2 получаются красно-коричневые р-ры, содержащие полиселениды вплоть
до Na2Se4. Селен раств. в р-рах сульфидов и полисульфидов
щелочных металлов с образованием тиоселенидов. При нагр. в р-ре Na2SO3
или KCN образует соотв. Na2SSeO3 или KCNSe. Сильные окислители
окисляют селен до Se(VI). Селен реагирует с алюминиевым порошком в щелочной среде:
. В HNO3 при нагревании селен окисляется до H2SeO3,
в конц. р-рах щелочей раств. с образованием селенида и селената(IV), в присут.
О2 получаются красно-коричневые р-ры, содержащие полиселениды вплоть
до Na2Se4. Селен раств. в р-рах сульфидов и полисульфидов
щелочных металлов с образованием тиоселенидов. При нагр. в р-ре Na2SO3
или KCN образует соотв. Na2SSeO3 или KCNSe. Сильные окислители
окисляют селен до Se(VI). Селен реагирует с алюминиевым порошком в щелочной среде:
12Se + 2Аl + 8NaOH
: 3Na2Se4 + 2NaAlO2 + 4H2O
Гидрид селена (селеноводород)
Н2Sе-бесцв. газ с неприятным запахом; т. кип. —41,35 °С, т. пл.
—65,72 °С; плотн. жидкого 2,12 г/см3; в сухом воздухе при комнатной
т-ре устойчив, во влажном постепенно окисляется до Se; при нагр. на воздухе
горит с образованием SeO2; мало раств. в воде (0,096 М при 15°С),
р-р имеет слабокислую р-цию; сильный восстановитель; получают из Se и Н2
при ~500 °С; используют для получения селена высокой чистоты, селенидов и селенорганических
соединений.
Гексафторид SеF6-бесцв.
газ; т.пл. — 34,6°С, т. возг. —46,6 °С; очень мало раств. в воде, не
гидролизуется. Тетрафторид SеF4-бесцв. жидкость; т. пл. -9,5°С,
т. кип. 101 °С; плотн. 2,75 г/см3; бурно реагирует с водой, разъедает
стекло. Получают фториды фторированием селена.
Тетрахлорид SеС14-бесцв.
или светло-желтые кристаллы; т. пл. 305 °С, т. возг. 196°С; плотн. 2,7
г/см3; водой гидролизуется, в конц. соляной к-те образует гексахлороселенистую
к-ту H2SeCl6; получают хлорированием селена; используют для
получения чистого селена и его соединений, как хлорирующий агент. Диселендихлорид
(монохлорид селена) Se2Cl2-маслянистая коричневая или темно-красная
жидкость; т. пл. — 85 °С, т. кип. 127°С (с разл.); плотн. 2,77 г/см3;
водой гидролизуется, этанолом и диэтиловым эфиром разлагается; получают взаимод.
Se с SeCl4; промежут. продукт в нек-рых способах получения и очистки
селена, реагент для синтеза
селенорг. соединений. Оксохлорид (селенилхлорид) SeOCl2-желтоватая
жидкость; т. пл. 10,9 °С, т. кип. 179,6°С; плотн. 2,445 г/см3;
дымит во влажном воздухе, легко гидролизуется; смешивается с ССl4,
CS2, СНСl3, бензолом; растворяет S, Se, I2,
хлориды мн. металлов; получают взаимод. SeO2 с SeCl4 при:
200 °С; используют для получения чистого селена, как хлорирующий агент, р-ритель,
пластификатор для полимеров.
Получение. Осн. источники
селена-шламы сернокислотного произ-ва (содержат своб. Se) и медеэлектролитные шламы
(содержат селениды тяжелых металлов). При небольшом содержании селена в шламах первого
типа их обогащают флотацией или экстракцией расплавл. S. Для извлечения селена шлам
или концентрат выщелачивают р-ром Na2S (из р-ра селен осаждается при
продувании воздуха) или Na2SO3 (с послед. действием H2SO4).
Применяют также окислит. обжиг с улавливанием возгона водой и послед. осаждением
селена действием NaHSO3 в соляной к-те или окислит. спекание шлама с
Na2CO3. После водного выщелачивания р-р подкисляется НС1,
осадок ТеО2 отфильтровывают, после чего селен осаждают действием FeSO4
[для восстановления Se(VI)] и SO2.
Из медеэлектролитных шламов
сначала удаляют Си обработкой разб. H2SO4 с продувкой
воздухом, а затем проводят окислит. обжиг с отгонкой SeO2 или спекание
с Na2CO3 в окислит. атмосфере с послед. водным выщелачиванием.
Часто окисление ведут без предварит. удаления меди нагреванием с конц. H2SO4,
после чего обжигом отгоняют SeO2. Его улавливают водой или содовым
р-ром и селен осаждают в кислой среде при действии SO2. Др. путь переработки
селенистых р-ров-восстановление металлич. А1 и осаждение селена продувкой воздухом.
Для концентрирования селенсодержащих р-ров применяют экстракцию, сорбцию на
анионитах из слабощелочных или нейтральных р-ров.
Из хим. методов рафинирования
чаще других используют сульфитно-циклич. метод, основанный на обратимой р-ции
селена с р-ром Na2SO3. Большинство др. хим. методов включает
окисление селена (напр., сжиганием в О2), очистку полученного SeO2
возгонкой, фильтрацией паров, ионным обменом и т.д. и затем восстановление SeO2,
напр. SO2 или Н2. Селен высокой чистоты получают также очисткой
через летучие соед.-Н2Sе, SеОСl2 и др.
После хим. очистки селен переплавляют,
расплав фильтруют через стеклоткань или активир. уголь, подвергают вакуумной
дистилляции или ректификации в инертной атмосфере.
Определение. Качественно
селен обнаруживают по появлению красного осадка или розового окрашивания при восстановлении
его соед. действием Na2S2O5, NH2OH,
Ph2N2H2 и др. до Se0, желтого окрашивания
или коричнево-красного осадка с 3,3'-диаминобензидином, синего или зеленого
окрашивания с пирокатехином, пирролом. Количественно селен определяют фотометрическими
или флуорометрическими методами с 3,3'-диаминобензидином, о-фенилендиамином
и др., а также измерением окраски коллоидных р-ров селена, полученных, напр., с
N2H4. Используют титриметрич. (тиосульфатный и иодометрич.),
полярографич., атомно-адсорбционный методы, редко-гравиметрический.
Применение. Аморфный селен
входит в состав светочувствит. слоев в ксерографии. Серый селен-полупроводниковый
материал (для диодов, фоторезисторов, мишеней видиконов и др.), пигмент для
стекла, присадка к стали, добавка к сере при вулканизации, его используют для
получения разл. катализаторов, гербицидов, инсектицидов, лек. препаратов, пигментов
и т.д.
Мировое произ-во селена (без
СССР) ок. 1700 т/год (1988). Соединения селена очень ядовиты; сам селен менее токсичен,
но пары его ядовиты; ПДК аморфного селена в воздухе 2 мг/м3, SeO2,
Na2SeO3 0,1 мг/м3, селена в воде 0,01 мг/л. Селен
открыт Й. Берцелиусом в 1817.
Лит.: Бэгнал К.,
Химия селена, теллура и полония, М., 1971; Назарен-ко И. И., Ермаков А. Н.,
Аналитическая химия селена и теллура, М., 1971; Исакова Р. А., Резняков А. А.,
СпивакМ.М., Рафинирование селена, А.-А., 1975; Букетов E. А., Угорец
М. 3., Гидрохимическое окисление халь-когенов и халькогенидов, А.-А., 1975;
Федоров П. И., в кн.: Химия и технология
редких и рассеянных элементов, под ред. К. А. Большакова, 2 изд., ч. 3, М.,
1976, с. 92-158; Грейвер Т. Н., Зайцева И. Г., Косовер В. М., Селен и теллур.
Новая технология получения в рафинирования, М., 1977; Есир-кегенов Г. М., Селен
и теллур, А.-А., 1981. П.И. Федоров.