Электролиты
ЭЛЕКТРОЛИТЫ, в-ва, в к-рых в заметной
концентрации присутствуют ионы, обусловливающие прохождение электрич. тока
(ионную проводимость). Электролиты также наз. проводниками второго рода. В узком
смысле слова электролиты-в-ва, молекулы к-рых в р-ре вследствие электролитической
диссоциации распадаются на ионы. Различают электролиты твердые,
растворы электролитов и ионные расплавы. Р-ры электролитов часто
также наз. электролитами. В зависимости от вида р-рителя различают электролиты водные и электролиты
неводные. Особый класс составляют высокомол. электролиты- полиэлектролиты.
В соответствии с природой ионов, образующихся
при электролитич. диссоциации водных р-ров, выделяют солевые электролиты (в них
отсутствуют ионы Н+ и ОН-), к-ты (преобладают ионы
Н+) и основания (преобладают ионы ОН-). Если при
диссоциации молекул электролита число катионов совпадает с числом анионов, такие
электролиты наз. симметричными (1,1 -валентными, напр. КС1, 2,2-валентными, напр.
CaSO4, и т.д.). В противном случае электролиты наз. несимметричными (1,2-валентные
электролиты, напр. H2SO4, 3,1-валентные, напр. А1(ОН)3,
и т.д.).
По способности к электролитич. диссоциации
электролиты условно разделяют на сильные и слабые. Сильные электролиты практически полностью
диссоциированы на ионы в разбавленных р-рах. К ним относятся многие неорг.
соли, нек-рые к-ты и основания в водных р-рах, а также в р-рителях, обладающих
высокой диссоциирующей способностью (напр., в спиртах, амидах, кетонах).
Молекулы слабых электролитов лишь частично диссоциированы на ионы, к-рые находятся
в динамич. равновесии с недиссоциир. молекулами. К слабым электролитам относятся
многие орг. к-ты и основания в водных и неводных р-рителях. Степень диссоциации
зависит от природы р-рителя, концентрации р-ра, т-ры и др. факторов. Один
и тот же электролит при одинаковой концентрации, но в разл. р-рителях образует
р-ры с разл. степенью диссоциации.
Электролитич. диссоциация приводит к увеличению
общего числа частиц в р-ре, что обусловливает существенное различие между
св-вами разбавл. р-ров электролитов и неэлектролитов. Этим, в частности,
объясняется увеличение осмотич. давления р-ра и его отклонение от закона
Вант-Гофа (см. Осмос), понижение давления пара р-рителя над р-ром
и его отклонение от Рауля закона, увеличение изменения т-ры кипения
и замерзания р-ра относительно чистого р-рителя и др.
Электролиты по своей структуре представляют собой сложные системы, состоящие из ионов, окруженных молекулами р-рителя, недиссоциированных молекул растворенного в-ва, ионных пар и более крупных агрегатов. Св-ва электролитов определяются характером ион-ионных и ион-молекулярных взаимод., а также изменением св-в и структуры р-рителя под влиянием растворенных частиц электролитов. В полярных р-рителях благодаря интенсивному взаимод. ионов с молекулами р-рителя образуются сольватные структуры (см. Сольватация). Роль сольватации с увеличением валентности ионов и уменьшением их кристаллографич. размеров возрастает. Мерой взаимод. ионов с молекулами р-рителя является энергия сольватации.
В зависимости от концентрации электролитов выделяют область разбавленных р-ров, к-рые по своей структуре близки к структуре чистого р-рителя, нарушаемой, однако, присутствием и влиянием ионов; переходную область и область концентрир. р-ров. Весьма разбавленные р-ры слабых электролитов по своим св-вам близки к идеальным р-рам и достаточно хорошо описываются классич. теорией электролитич. диссоциации. Разбавленные р-ры сильных электролитов заметно отклоняются от св-в идеальных р-ров, что обусловлено электростатич. межионным взаимод. Их описание проводится в рамках Дебая-Хюккеля теории, к-рая удовлетворительно объясняет концентрационную зависимость термодинамич. св-в - коэф. активности ионов, осмотич. коэф. и др., а также неравновесных св-в -электропроводности, диффузии, вязкости (см. Электропроводность электролитов). При повышении концентрации р-ров сильных электролитов возникает необходимость в учете размера ионов, а также влияния сольватационных эффектов на характер межионного взаимодействия.
В переходной концентрационной области под влиянием ионов происходит существенное изменение структуры р-рителя. При дальнейшем увеличении концентрации электролита почти все молекулы р-рителя связаны с ионами в сольватационные структуры и обнаруживается дефицит р-рителя, а в области концентрированных р-ров структура р-ра все более приближается к структуре соответствующих ионных расплавов или кристаллосольватов. Данные компьютерного моделирования и спектроскопич. исследований, в частности методом рассеяния нейтронов с изотопным замещением, свидетельствуют о значит. степени упорядоченности в концентрированных р-рах электролитов и об образовании специфич. для каждой конкретной системы ионных структур. Напр., для водного р-ра NiCl2 характерен комплекс, содержащий ион Ni2+, окруженный 4 молекулами воды и 2 ионами Сl- в октаэдрич. конфигурации. Ионные комплексы связываются между собой посредством связей галоген - водород - кислород и более сложных взаимод., включающих молекулы воды.
В ионных расплавах специфика упорядочения характеризуется структурными факторами
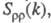
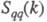 и
и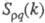 , описывающими
флуктуации ионной плотности
, описывающими
флуктуации ионной плотности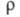 и заряда q как ф-ции волнового числа k, к-рое с точностью
до постоянной Планка h совпадает с величиной импульса, передоваемого
расплаву рассеивающей частицей, напр. нейтроном. Для бинарного электролита
и заряда q как ф-ции волнового числа k, к-рое с точностью
до постоянной Планка h совпадает с величиной импульса, передоваемого
расплаву рассеивающей частицей, напр. нейтроном. Для бинарного электролита
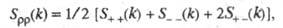
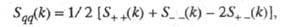
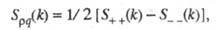
где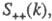
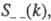
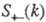 - парциальные структурные факторы, относящиеся к взаимод. катионов и анионов
между собой и друг с другом. Для расплавов типа NaCl ф-ция
- парциальные структурные факторы, относящиеся к взаимод. катионов и анионов
между собой и друг с другом. Для расплавов типа NaCl ф-ция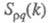 близка к нулю, вследствие чего электролит можно рассматривать как смесь двух жидкостей,
одна из к-рых характеризуется упорядочением по ионной плотности через ф-цию
близка к нулю, вследствие чего электролит можно рассматривать как смесь двух жидкостей,
одна из к-рых характеризуется упорядочением по ионной плотности через ф-цию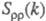 ,
а вторая -"зарядовым" упорядочением через ф-цию
,
а вторая -"зарядовым" упорядочением через ф-цию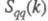 .
Ф-ция
.
Ф-ция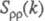 имеет типичное поведение для систем с "плотностным" упорядочением, отражая
значит. степень беспорядка в расположении частиц. В отличие от этого
имеет типичное поведение для систем с "плотностным" упорядочением, отражая
значит. степень беспорядка в расположении частиц. В отличие от этого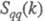 имеет резкий пик, отражающий сильное упорядочение в распределении заряда,
определяемое экранированием и требованиями локальной электронейтральности.
Такое упорядочение ионов приводит к возможности существования в электролитах коллективных
возбуждений, к-рые могут проявляться в виде пиков динамич. структурного
фактора
имеет резкий пик, отражающий сильное упорядочение в распределении заряда,
определяемое экранированием и требованиями локальной электронейтральности.
Такое упорядочение ионов приводит к возможности существования в электролитах коллективных
возбуждений, к-рые могут проявляться в виде пиков динамич. структурного
фактора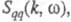 описывающего динамику флуктуации плотности заряда расплава (
описывающего динамику флуктуации плотности заряда расплава (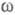 - частота, связанная с энергией, передаваемой расплаву рассеивающей частицей).
Для ионных расплавов электролитов, катионы к-рых склонны к образованию ковалентных
связей с анионами (напр., для расплава CuCl), наблюдается сильная корреляция
взаимод. между анионами и довольно слабая - между катионами.
- частота, связанная с энергией, передаваемой расплаву рассеивающей частицей).
Для ионных расплавов электролитов, катионы к-рых склонны к образованию ковалентных
связей с анионами (напр., для расплава CuCl), наблюдается сильная корреляция
взаимод. между анионами и довольно слабая - между катионами.
Переход от одной концентрационной области
электролитов в другую происходит плавно, вследствие чего рассмотренное выше деление
является условным. Тем не менее в промежут. области нек-рые термодинамич.
св-ва электролитов, напр. коэф. р-римости, претерпевают заметные изменения. Описание
промежут. и концентрационной областей требует явного рассмотрения как ионов,
так и молекул р-рителя и учета разл. видов взаимод. между всеми частицами
в р-ре.
В зависимости от т-ры и давления выделяют
низкотемепературную и высокотемпературную области св-в электролитов, а также области
нормальных и высоких давлений. Повышение т-ры или давления в целом снижают
мол. упорядоченность р-рителя и ослабляет влияние ассоциативных и сольватационных
эффектов на св-ва р-ра электролита. При понижении т-ры иже т-ры плавления нек-рые
концентрир. электролиты могут находиться стеклообразном состоянии, напр. водные
р-ры LiCl.
Наряду с электролитами как проводниками второго рода
существуют в-ва, обладающие одновременно электронной и ионной проводимостью.
К ним относятся р-ры щелочных и щел.-зем. металлов в полярных р-рителях
(аммиак, амины, эфиры), а также в расплавах солей. В этих системах при
изменении концентрации металла происходит фазовый переход в металлич. состояние
с существенным (на неск. порядков) изменением электропроводности. При этом
в электролитич. области образуется самый легкий анион-сольватированный
электрон, придающий р-ру характерный синий цвет.
Электролиты играют важную роль в науке и технике.
Они участвуют в электрохим. и многих биол. процессах, являются средой для
орг. и неорг. синтеза и электрохим. произ-в. Изучение св-в электролитов важно для
выяснения механизмов электролиза, электрокатализа, электрокристаллизации,
коррозии металлов и др., для совершенствования механизмов разделения в-в
- экстракции и ионного обмена. Исследование св-в электролитов стимулируется энергетич.
проблемами (создание новых топливных элементов, солнечных батарей, электрохимических
преобразователей информации), а также проблемами защиты окружающей
среды.
Лит.: Харнед Г., Оуэн Б., Физическая химия растворов электролитов, пер. с англ., М., 1952; Термодинамика и строение растворов. Материалы симпозиума "Химия водных систем при высоких температурах и давлениях", Иваново, 1986; March N.H., Тоsi M. P., Coulomb liquids, L.-[a.o.], 1984; см. также лит. к ст. Растворы электролитов, Электропроводность электролитов, Электролиты неводные, Электролиты твердые.
М. Ф. Головко.