§ 3. Адсорбция
Еще в конце XVIII века было известно, что на поверхности твердых тел способны поглощаться газы, пары и растворенные вещества. Явление это носит общее название адсорбции. Особенно часто приходится встречаться с адсорбцией паров воды, в большей или меньшей степени поглощаемых поверхностью всех предметов, находящихся в соприкосновении с воздухом. Такая адсорбированная или, как ее иногда называют гигроскопическая, вода существенно влияет на некоторые свойства самих поглощающих веществ, и поэтому с ней приходится считаться при многих производственных процессах.
Одним из веществ с наиболее сильно развитой способностью к адсорбции, т. е. поглощению на поверхности, является древесный уголь. Обработка перегретым паром при высокой температуре сильно повышает его адсорбционные качества, и такой активированный уголь стал важнейшей составной частью основного средства защиты дыхательных путей от отравляющих веществ – противогаза. При прохождении через коробку последнего вредные вещества задерживаются на поверхности угля и таким образом в дыхательные пути поступает уже освобожденный от них воздух.
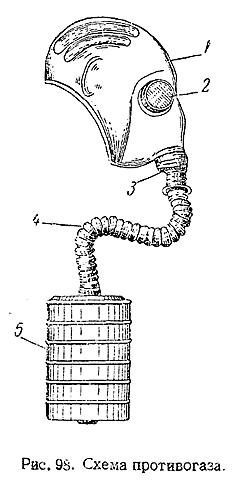
1) На рие. 98 показан один из типов противогаза: 1 – резиновый шлем, надевающийся на голову; 2 – очки; 3 – выдыхательный клапан; 4 – гибкая соединительная труба из покрытой трикотажем резины; 5 – поглотительная коробка (находящаяся во время пользования противогазом в особой сумке). Кроме угля, в состав поглотителя входят некоторые добавки, химически связывающие отравляющие вещества, а также специальная прокладка, служащая для задерживания не поглощаемых углем твердых частиц ядовитых дымов.
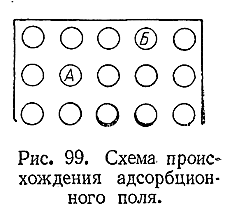
Происхождение адсорбционной способности можно выяснить на основе рис. 99. У любого твердого тела отдельные его частицы (атомы, молекулы или ионы) расположены в известном порядке. При этом частица внутри тела находится в иных условиях, чем расположенная на его поверхности. Действительно, частица А окружена другими такими же частицами равномерно со всех сторон.
Ее внешнее силовое поле, следовательно, со всех сторон одинаково компенсировано подобными же полями соседних частиц. В ином положении находится частица А, так как ее поле с внешней стороны не компенсировано. Поэтому на поверхности остается свободное силовое поле, за счет которого к твердому телу и могут притягиваться частицы тех или других веществ из соприкасающегося с ним газа или раствора.
Сила адсорбционного поля и его характер определяются природой данного адсорбента (поглотителя) и расположением частиц на его поверхности. Кроме того, адсорбционная способность зависит и от величины поверхности. Поэтому понятно, что отдельные адсорбенты могут очень сильно отличаться друг от друга по своей поглотительной способности как количественно, так и качественно.
2) Иногда вслед за адсорбцией может происходить растворение адсорбированного вещества в поглотителе, т. е. переход его с поверхности внутрь последнего (абсорбция). Именно так, по–видимому, протекает поглощение водорода металлическим палладием. Рассматриваемый в совокупности процесс адсорбции и абсорбции носит общее название сорбции, а обратное выделение сорбированного вещества в окружающую среду – десорбции.
3) Особым случаем адсорбции из растворов является поглощение поверхностью построенного по ионному типу осадка одних ионов преимущественно перед другими. При этом обычно соблюдается общее правило, согласно которому предпочтительно адсорбируются такие ионы, которые образуют малорастворимое (или малодиссоциированное) соединение с противоположно заряженным ионом самого осадка.
Особенно часто приходится встречаться с поглощением поверхностью осадка тех ионов, которые входят в его собственный состав. Если, например, производить осаждение AgNO3 избытком раствора НСl, то осадком AgCl поглощаются главным образом ионы Сl'. Наоборот, при осаждении НСl избытком AgNO3 на AgCl адсорбируются преимущественно ионы Ag+.
Практическое значение адсорбционных явлений очень велико. Противогазы той или иной конструкции широко применяются при работе в различных вредных производствах. Адсорбция непосредственно используется при выработке сахара (для его очистки), в нефтяной промышленности (для улавливания бензина из природных газов) и т. д. Адсорбционные процессы лежат в основе крашения тканей, дубления кож и т. д.
Адсорбция играет основную роль при протекании многих каталитических реакций и в химии коллоидных растворов. На ней основаны также некоторые методы аналитической химии. Так, лучшая реакция открытия свободного иода – синее окрашивание им крахмала – обусловлена образованием адсорбционного соединения. Очень большое значение приобрел в настоящее время т. н., хроматографический метод разделения веществ, основанный на различном поглощении адсорбентом отдельных составных частей исходной смеси.