§ 2. Платиновые металлы
Все платиновые металлы относятся к числу мало распространенных элементов. Содержание каждого из них в земной коре оценивается следующими величинами (в %):

Скопления платиновых металлов встречаются очень редко и содержат их почти исключительно в самородном состоянии, как незначительную примесь к другим продуктам выветривания горных пород. Количество самой платины в подобных россыпях (аналогичных золотым) обычно бывает гораздо больше, чем остальных металлов платиновой группы. Отделение последних от платины и друг от друга представляет значительные трудности, чем отчасти и обусловлена высокая стоимость рассматриваемых элементов.
1) Ежегодная мировая добыча платиновых металлов составляет около 25 т. Значительные количества палладия (и платины) получают не из платиновых месторождений, а как побочный продукт при переработке никелевых руд. Размеры добычи платины и палладия гораздо больше, чем остальных платиновых металлов.
В свободном состоянии элементы платиновой группы представляют собой тугоплавкие и труднолетучие металлы, по плотности разделяемые иногда на легкие (Ru, Rh, Pd) и тяжелые (Os, Ir, Pt). Их важнейшие константы сопоставлены ниже:
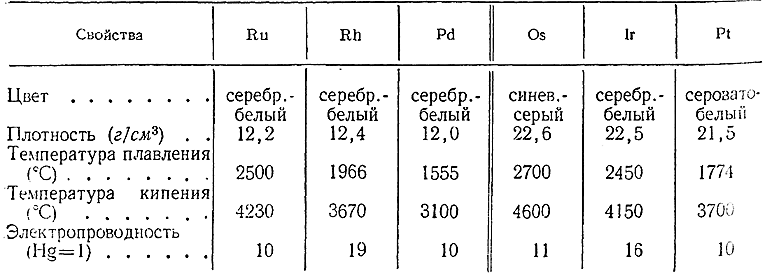
Палладий и платина хорошо поддаются механической обработке, тогда как Ru, Rh, Os и Ir более тверды и хрупки. Для большинства элементов платиновой группы характерна способность поглощать некоторые газы, в частности водород.
2) Наименее активен по отношению к водороду осмий, в компактном состоянии практически не поглощающий этого газа. Наиболее активен палладий, один объем которого способен при обычной температуре поглотить более 700 объемов водорода. Металл при этом вспучивается, становится хрупким и покрывается трещинками. Растворимость водорода в платине гораздо меньше, чем в палладии (причем заметна лишь при повышенных –температурах). Напротив, кислород платина растворяет лучше палладия: при 450 °С один объем платины может поглотить около 70 объемов кислорода, а один объем палладия – 0,07 объема.
По отношению к химическим воздействиям элементы платиновой группы чрезвычайно устойчивы. В виде компактных металлов большинство из них (кроме Pd и Pt) нерастворимо не только в обычных кислотах, но и в царской водке. Последняя легко растворяет платину, а палладий растворим также в HNO3 .
Даже наиболее активные металлоиды при обычных температурах на компактные платиновые металлы не действуют. Более или менее энергичное взаимодействие может быть вызвано нагреванием, причем наблюдаются интересные индивидуальные особенности отдельных элементов: по отношению к кислороду устойчивее других металлов платина, по отношению к сере – рутений, по отношению к хлору – иридий, по отношению к фтору – родий. Наиболее энергично реакции протекают у осмия, тонкий порошок которого медленно окисляется на воздухе (до OsO4 ) даже при обычных условиях. Меньшая химическая устойчивость в очень мелко раздробленном состоянии {в виде «черни») по сравнению с компактным характерна и для других платиновых металлов.
Наибольшее практическое значение из элементов платиновой группы имеет сама платина. Она служит для выработки отдельных частей аппаратуры химических заводов, нагревательной обмотки электрических печей, приборов для измерения высоких температур и т. д. Весьма важное применение находит она также в качестве катализатора при различных производственных процессах химической промышленности. Однако около половины всей мировой добычи платины тратится малопроизводительно путем использования ее в ювелирном и зубоврачебном деле.
Соединения элементов платиновой группы сколько–нибудь значительного практического применения пока не находят. Они весьма многочисленны и разнообразны по типам, так как у отдельных металлов известны производные, отвечающие самым различным валентностям – от I до VIII. Однако некоторые из последних малохарактерны и встречаются лишь как исключения. Все элементы платиновой группы отличаются чрезвычайно сильно выражений тенденцией к комплексообразованию.
Производные двухвалентных элементов особенно характерны для палладия и отчасти платины. Последняя образует очень большое число комплексных соединений, но лишь немного простых. Напротив, для палладия двухвалентное состояние является наиболее устойчивым и в том и в другом случае.
Из простых соединений Pd2+наиболее важны его соли, большая часть которых легкорастворима. В растворе уже при обычной температуре PdCl2 легко восстанавливается до металла под действием окиси углерода:
PdCl2 + Н2 О + СО = СО2 + 2НСl + Pd
На этом основано его применение для открытия СО.
Комплексные производные двухвалентных палладия и платины весьма многочисленны и разнообразны по составу. Наиболее устойчивым из них является платиносинеродистая кислота – H2 [Pt(CN)4 ]. Весьма характерны для платины также хлороплатиниты – соли комплексной кислоты H2 [PtCl4 ].
Соединения трехвалентных элементов наиболее характерны для родия и иридия. Их гидроокиси – желтая Rh(OH)3 и зеленая Ir(ОН)3 – практически нерастворимы в воде. Обе они характеризуются слабо выраженными основными свойствами, а при нагревании легко теряют воду, переходя в черные окислы Э2 О3 . Помимо обычных солей, для обоих элементов известно очень много разнообразных комплексных соединений.
Отвечающие четырехвалентным элементам двуокиси ЭО2 известны для всех платиновых металлов (частично – лишь в форме гидратов). Другие производные этой валентности особенно характерны для самой платины. Красно–коричневая Pt(OH)4 растворима ив кислотах и в сильных щелочах, причем продуктами взаимодействия являются, как правило, не простые соли, а комплексные соединения. Например, взаимодействие с NaOH и НСl протекает по схемам:
2NaOH + Pt(OH)4 = Na2 [Pt(OH)6 ]
Pt(OH)4 + 6HCl = H2 [PtCl6 ] + 4H2 O
Образование комплексных аммиакатов характерно лишь для платины, причем большинство их отвечает типам [Pt(NH3 )6 ]X4 и [Pt(NH3) 4X2 ]X2 . Напротив, анионные комплексы общей формулы М2 [ЭХ6 ] (где X большей частью галоид) известны для всех металлов платиновой группы. Устойчивость их наибольшая у производных платины.
Являющаяся обычным продажным препаратом этого элемента свободная платинохлористоводородная кислота (H2 [PtCl6 ]) может быть получена растворением платины в насыщенной хлором соляной кислоте:
Pt + 2Сl2 + 2НСl = H2 [PtCl6 ]
Образованием желтых осадков труднорастворимых хлороплатинатов NH4 +, K+, Rb+и Cs+пользуются иногда для открытия перечисленных катионов.
Производные шестивалентных элементов наиболее характерны для осмия и рутения. Оба металла при сплавлении их со щелочами в присутствии окислителей образуют соли осмиевой или рутениевой кислоты общей формулы М2 ЭО4 по схеме, например:
Э + 3KNO3 + 2КОН = К2 ЭО4 + 3KNO2 + Н2 О
Как осматы, так и рутенаты в обычных условиях довольно неустойчивы, однако типичный для них характер изменений существенно различен. Рутенаты легко восстанавливаются до RuO2 , которая является наиболее устойчивым кислородным соединением рутения. Напротив, осматы легко окисляются до OsO4 .
Соединения восьмивалентных элементов известны только для осмия и рутения. Взаимодействие порошка металлического осмия с фтором около 250°С ведет к образованию бесцветных паров OsF4 , при охлаждении сгущающихся в лимонно–желтые кристаллы (т. пл. 34 °С, т. кип. 48 °С). С химической стороны восьми–фтористый осмий характеризуется резко выраженными окислительными свойствами. Водой он постепенно разлагается по уравнению:
OsF8 + 4Н2 О = 8HF + OsO4
Четырехокись осмия является наиболее устойчивым при обычных условиях окислом этого элемента и медленно образуется из мелко раздробленного металла и его соединений уже при хранении на воздухе. Четырехокись рутения может быть получена обработкой раствора K2 RuO4 избытком хлора (K2 RuO4 + Cl2 = 2KCl + RuO4 ). Обе четырехокиси представляют собой легколетучие кристаллические вещества бледно–желтого (OsO4 ) или золотисто–желтого (RuO4 ) цвета. В воде они довольно хорошо растворимы, причем растворы не показывают кислой реакции на лакмус.
Хотя сильными окислителями являются обе четырехокиси, однако различие их устойчивости проявляется довольно отчетливо. В то время как OsO4 кипит при 131 °С без разложения, четырехокись рутения при нагревании до 108 °С со взрывом распадается на RuO2 и кислород. При обычных условиях и без соприкосновения с восстановителями OsO4 изменениям не подвергается, тогда как RuO4 может сохраняться только в отсутствие света и влаги. Четырехокись осмия хорошо растворима в спирте, причем восстанавливается им до OsO2 лишь медленно, a RuO4 при соприкосновении со спиртом взрывает. В общем, следовательно, RuO4 значительно менее устойчива, чем OsO4 , и ее окислительные свойства выражены резче. Пары обеих четырехокисей весьма ядовиты.
При всем многообразии образуемых элементами платиновойгруппы соединений основное для химии их практическое использование связано с каталитическими свойствами самих металлов. Ускоряя разнообразные химические процессы, они иногдаособенно способствуют реакциям, протекающим при участии газообразного водорода. Наиболее интересен с этой стороны палладий, в присутствии которого водород уже на холоду и в темноте восстанавливает хлор, бром, иод и кислород, переводит SO2 в H2 S, СlO3 в Cl–, FeCl3 в FeCl2 и т. д. При одновременном наличии кислорода и воды насыщенный водородом палладий способен превращать N2 в NH4 NO2 , т. е. осуществлять связывание свободного азота в обычных условиях температуры и давления.
3) Так как каталитическая активность металла тем больше, чем сильнее развита его поверхность, при изготовлении катализаторов стараются по возможности ее увеличить. С этой целью металл часто осаждают на каком–нибудь индифферентном пористом материале, например асбесте. В частности, платинированный асбест может быть получен пропиткой асбеста разбавленным (1–2%) раствором H2 [PtCl6 ] с последующим его прокаливанием (что вызывает распад по уравнению:
H2 [PtCl6 ] = 2HCl + 2Cl2 + Pt).
Однако металлические катализаторы часто готовят и без индифферентной основы. Та или иная наиболее удобная для каждого конкретного случая степень дробления металла достигается при этом применением различных методов его выделения. Например, губчатая платина может быть получена слабым прокаливанием (NH4 )2 [PtCl6 ], содержащая более мелко раздробленный металл платиновая чернь – восстановлением раствора H2 [PtCl6 ] металлическим цинком
H2 [PtCl6 ] + 3Zn = 3ZnCl2 + H2 + Pt)
а еще более раздробленная коллоидная платина – восстановлением того же раствора хлористым оловом
H2 [PtCl6 ] + 2SnCl2 = 2SnCl4 + 2HCl + Pt
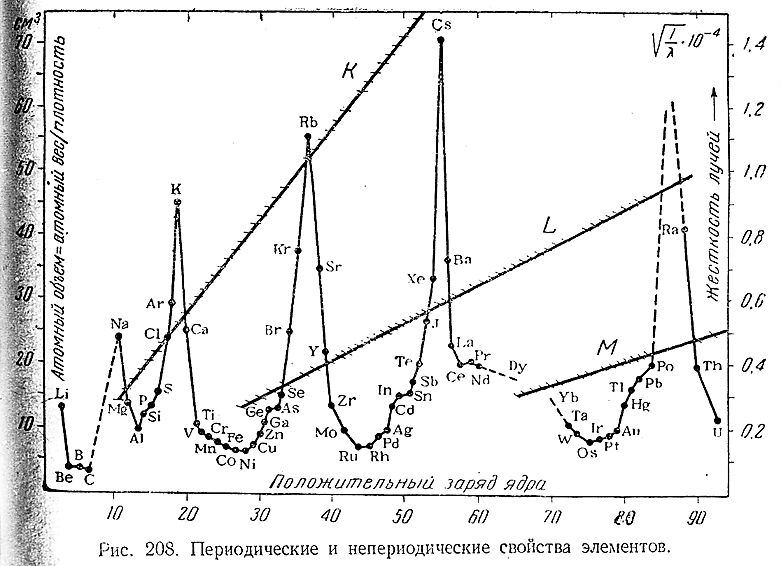
Несмотря на многие отдельные различия, платиновые металлы в общем похожи на элементы семейства железа. И те и другие являются серебристо–белыми или серыми металлами, характеризующимися трудной летучестью, причем их температуры плавления в группе изменяются довольно закономерно, уменьшаясь при переходе снизу вверх и слева направо (наиболее тугоплавок осмий, наименее – никель) Для всех металлов VIII группы характерна высокая каталитическая активность. Их ионы проявляют сильно выраженную тенденцию к комплексообразованию. Производящиеся от них соединения в подавляющем большинстве окрашены.
Почти все элементы VIII группы образуют соединения, отвечающие нескольким различным валентностям, причем изменение последних осуществляется сравнительно легко. При переходе в группе снизу вверх и слева направо наиболее типичная для того или иного элемента валентность в общем, как это видно из приводимого сопоставления, понижается:
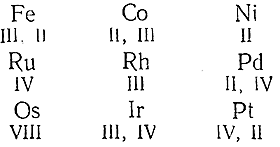
Между элементами вертикальных столбцов проявляются отдельные черты и более близкого сходства. Например, для всехкленов ряда Со, Rh, Ir (в противоположность остальным элементам группы) характерно образование аммиакатов типа [Э(NН3 )6 ]Х3 . Члены ряда Fe, Ru, Os являются особенно активными катализаторами при синтезе аммиака из элементов, a Ni, Pd и Pt – при реакциях присоединения водорода к органическим соединениям. Для Fe, Ru и Os кислородные соединения характернее сернистых, тогда как в ряду Ni, Pd, Pt наблюдается обратное. В этом, равно как и в некоторых других отношениях, Fe, Ru и Os похожи на Мn, Тс и Re, a Ni, Pd и Pt – на Cu, Ag и Au. По своим химическим свойствам члены VIII группы являются таким образом переходными между примыкающими к ним элементами подгруппы марганца, с одной стороны, и подгруппы меди – с другой.