§ 3. Заключительный обзор элементов
Если сопоставить те или иные свойства различных химических элементов, то оказывается, что подавляющее большинство этих свойств является периодической функцией положительного заряда ядра и лишь немногие зависят от него линейно. Как видно из рис. 208, линейно изменяются, в частности, характерные для элементов частоты колебаний рентгеновских лучей (в зависимости от жесткости отвечающие линиям К, L и М). Хороший пример четко выраженной периодической закономерности дают атомные объемы, т. е. объемы, занимаемые грамм–атомами элементов в твердом состоянии.
Линейный характер зависимости для частот колебаний обусловлен тем, что они определяются непосредственно величиной положительного заряда ядра. Напротив, периодически изменяющиеся свойства связаны с внешними частями атома, т. е. пространственным распределением окружающих ядро электронов. Но основная сущность периодического закона именно и заключается в том, что идущее по мере увеличения положительного заряда ядра (а следовательно, и числа внешних электронов) последовательное развитие атомных структур протекает с периодическим образованием сходных электронных систем. Поэтому все свойства, связанные с распределением электронов в атомах, должны также изменяться периодически, что и наблюдается, в частности, для атомных объемов.
Одной из важнейших практических характеристик элементов является их распространенность в природе. Ниже сопоставлены цифры атомных процентов для наиболее распространенных в земной коре элементов:
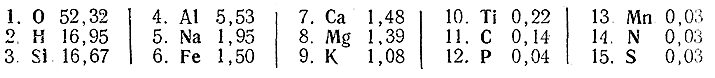
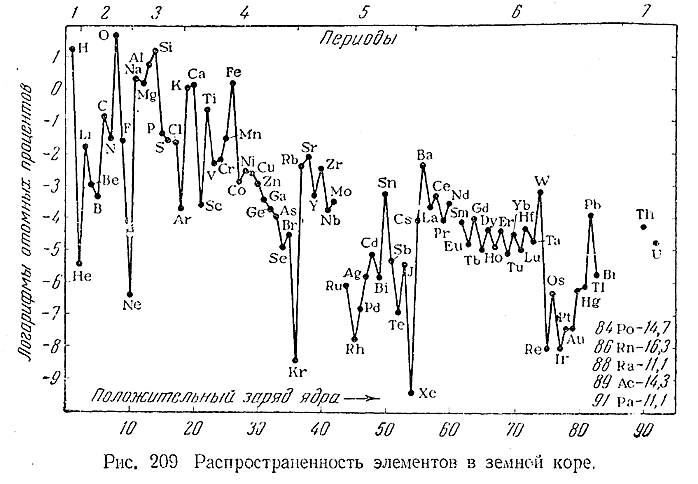
Как показывают приведенные данные, из общего числа составляющих земную кору (все три оболочки – воздушную, водную и верхнюю часть твердой) атомов 99,4% приходится на долю только 15 элементов, а содержание всех остальных вместе взятых составляет лишь 0,6%. Из рис. 209 видно, что относительная распространенность элементов является хотя и очень сложной, но все же определенно периодической функцией положительного заряда ядра.
Газообразны при обычных условиях только Н, N, О, F, Cl и инертные газы, т. е. элементы, расположенные в верхней и правой части периодической системы. Жидкие при обычных условиях Вr и Hg. Вследствие легко наступающего переохлаждения в жидком состоянии нередко сохраняются также Cs (т. пл. +28°С) и Ga( + 30°С). Остальные элементы при обычных условиях тверды.
В свободном состоянии подавляющее большинство элементов имеет металлический вид с оттенками от серебристо–белого до темно–серого, причем это относится не только к типичным металлам, но и к ряду металлоидов: С (графит), Si, As, Se, Те. Лишь немногие элементы при сохранении общего металлического вида имеют иные оттенки. Так, Cu окрашена в красный цвет, Au – в желтый, Bi характеризуется красноватым оттенком, Pb – синеватым, J – темно–фиолетовым. Из элементов, не имеющих металлического вида, S окрашена в желтый цвет, F – в очень бледный зеленовато–желтый, Сl – в желто–зеленый и Br – в красно–коричневый. Бесцветными являются Н, N, О и инертные газы, а из твердых элементов – только фосфор (белый) и углерод (алмаз). Как показывает приведенный перечень, для всех элементов 4–7 периодов, кроме брома и инертных газов, характерен металлический вид. Не имеющие его элементы сосредоточены в верхней правой части развернутой формы периодической системы (стр.161).
Такие физические свойства, как радиус атома, температура плавления, плотность, твердость и т. д., зависят от типа кристаллической решетки и, строго говоря, могут подвергаться сравнению только при его одинаковости для сопоставляемых элементов. В общем все эти свойства показывают более или менее отчетливо выраженную периодическую зависимость от положительного заряда ядра.
По своему общему химическому характеру большинство элементов является металлами. Все они располагаются в левой и нижней частях системы, причем в качестве пограничных представителей можно рассматривать Be, Al, Ge, Sb и Ро. Правую верхнюю часть системы заполняют элементы металлоидного характера, причем их пограничными представителями являются В, Si, As, Те и At. Таким образом, приблизительную границу между металлами и металлоидами можно провести по линии, проходящей между обоими приведенными рядами элементов.
При переходе слева направо или снизу вверх в малых периодах (кроме первого) наблюдается отчетливое ослабление металла–ческого или усиление металлоидного характера элементов. Сложнее обстоит дело в больших периодах, где для рядов аналогов 1–3 и 14–17 сохраняется в общем та же закономерность, тогда как переход по рядам 4–13 слева направо не сопровождается четким последовательным изменением свойств, а переход снизу вверх обычно ведет не к ослаблению, а к усилению металлического характера элементов. Из сопоставления – друг с другом рядов, входящих в одну и ту же группу (1 и 11, 2 и 12 и т. д.), вытекает, что элементы левого ряда всегда имеют более отчетливо выраженные металлические свойства, чем правого. Особняком в ряду своих аналогов стоит водород, металлоидный характер которого (из–за малого заряда ядра) выражен слабее, чем у иода. В общем, следовательно, наиболее активными металлами являются элементы левого нижнего угла (Fr,. Cs, Ra), наиболее активными металлоидами – элементы верхнего правого угла (F, О, Сl) периодической системы.
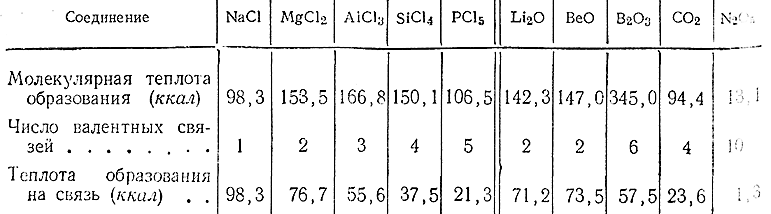
Взаимодействие между элементами протекает, как правило, тем более энергично, чем сильнее они отличаются друг от друга по своему химическому характеру. Поэтому, например, теплоты образования соединений между членами одного и того же периода обычно тем больше, чем дальше они расположены друг от друга. В качестве иллюстрирующего эту закономерность примера ниже приводятся теплоты образования некоторых соединений между элементами 3 и 2 периодов. Так как формулы этих соединений различны, данные для них непосредственно сопоставляться не могут и должны быть предварительно приведены к сравнимому виду. Для этого теплоты образования грамм–молекул делят на число имеющихся в соединении валентных связей и получают таким образом величины, отнесенные к одному грамм–эквиваленту (теплоты образования «на связь»). Последние уже могут быть сопоставлены друг с другом. Ход расчета виден из данных приводимой ниже таблицы.
Валентности химических элементов сопоставлены на рис. 210, причем более характерные из них обозначены точками большегоразмера. Хотя валентность, вообще говоря, зависит от природы обоих взаимодействующих атомов (а также и от внешних условий), однако у многих элементов она остается практически постоянной. Для других (например, Mn, Ru) наблюдается, наоборот, проявление очень большого ее разнообразия.
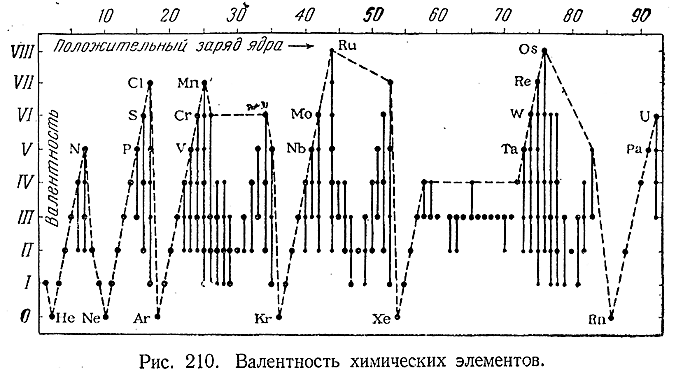
Из элементов малых периодов (1–3) переменная валентность характерна только для N, P, S и Сl. Гораздо распространеннее она среди членов больших периодов (4–7), причем в началах этих периодов тенденция к образованию соединений низших валентностей при переходе по рядам (4–10) снизу вверх усиливается, а в их концах (ряды 13–16) ослабевает. У подобных элементов с переменной валентностью максимальная из них наблюдается обычно в кислородных и фтористых соединениях, минимальная– в соединениях с другими галоидами (и особенно в комплексных цианидах).