Этилен
Кроме общих способов получения, этилен С2Н4 всегда образуется при сухой перегонке различных органических веществ. Он присутствует обыкновенно в светильном газе. Вода при 0° С растворяет 0,25 объема этилена, спирт растворяет 3,59 объема.Этилен устойчив приблизительно до 350° С; выше этой температуры он начинает разлагаться на метан и ацетилен:
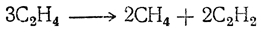
При более высоких температурах этилен разлагается на ацетилен и водород
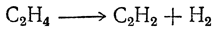
а при еще более высоких — на углерод (уголь) и водород.
Этилен раньше называли также «маслородным газом», так как с хлором он дает маслообразный 1,2-дихлорэтан («масло голландских химиков»). Отсюда произошло и название этиленовых углеводородов — «олефины» (oleum — лат. масло).
Этилен и его ближайшие гомологи, получаемые наряду с этиленом при процессах пиролиза и крекинга нефти и ее тяжелых погонов, являются исходным сырьем для промышленного производства синтетического этанола, изопропилового спирта, ацетона, различных алкилбензолов, бутадиена (для синтеза каучука) и т. д.
Этилен имеет и некоторое самостоятельное применение. Кислородно-этиленовое пламя применяется для автогенной сварки металлов, вдыхание этилена используется для наркоза при хирургических операциях. Наконец, он применяется для ускорения созревания плодов, для чего достаточно ничтожного содержания этилена в воздухе.