Типы химических связей
Существует большое разнообразие химических связей, отличных по тем или иным признакам. Все связи могут быть подразделены на несколько типов по принципу их электронного строения. Ниже приводится принятая в настоящее время классификация химических связей.
Гетерополярная (электровалентная) связь
Если между двумя атомами или двумя группами атомов имеет место электростатическое взаимодействие, приводящее к сильному притяжению и образованию химической связи, то такая связь называется гетерополярной или электровалентной.
Наиболее важной из связей этого типа является ионная связь, обусловленная электростатическим притяжением избыточных электрических зарядов противоположно заряженных ионов. Атомы металлов, например, легко теряют свои внешние электроны, а атомы неметаллов, наоборот, стремятся присоединить добавочные электроны. Таким образом, могут возникнуть устойчивые катионы и анионы, которые в основном сохраняют
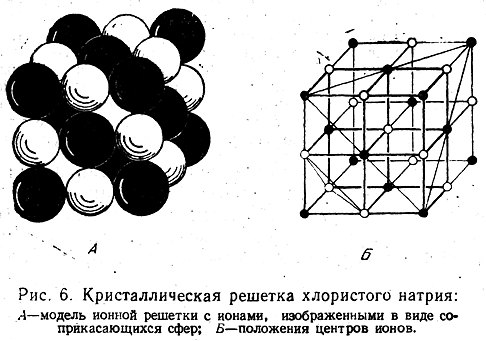
свое электронное строение при приближении друг к другу и при образовании молекулы или кристалла. В кристаллах галогени-дов щелочных металлов нет отдельных молекул МеХ. Кристаллы состоят из катионов металла и анионов галоида. Кристаллическая решетка большинства галогенидов построена так, как это изображено на рис. 6 для хлористого натрия.
Между каждым из ионов одного знака и шестью ионами с зарядами противоположного знака, образующими октаэдр вокруг данного иона, существует сильное взаимное притяжение. Иными словами, каждый ион образует ионные связи с шестью своими соседями. Эти связи объединяют все ионы в кристалле в одну гигантскую молекулу. В таких кристаллах координационное число ионов равно шести, причем под координационным числом подразумевается число ближайших соседей.
В хлористом, бромистом и иодистом цезии кристаллическая решетка имеет другое строение, при котором все ионы в вершинах куба одинаковы, а ионы противоположного знака образуют подобную же систему кубов, вершины которых находятся в центрах кубов первой системы. В этом случае координационное число равно восьми.
Ионно построенные молекулы обычно изображаются следующим образом: Na+Cl-, K+Br- или Na·Сl', K·Сl'и т. д.
Гетерополяр'ные связи могут быть обусловлены притяжением между ионом и молекулой, обладающей постоянным или наведенным диполем, а также взаимным притяжением постоянных диполей двух молекул. Некоторые из таких связей будут подробно рассмотрены ниже.
Предыдущая страница |
Сдедующая страница
СОДЕРЖАНИЕ