Молекулярная рефракция
Наиболее разработанными и наиболее важными для исследования органических веществ являются закономерности в изменениях показателя преломления в зависимости от состава и строения вещества. Показатель преломления является одной из констант, хорошо характеризующих чистоту и индивидуальность жидких органических веществ.
Весьма важным является то обстоятельство, что формула удельного лучепреломления, формула Лорентца—Лоренца
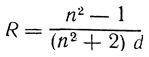
(где п — наблюденный показатель преломления, a d — плотность вещества при той же температуре), дает выражение удельной рефракции R, независимой от температуры, давления и агрегатного состояния вещества. Удельная рефракция является мерой действительного объема молекулы. Произведение R×M называется молекулярной рефракцией.
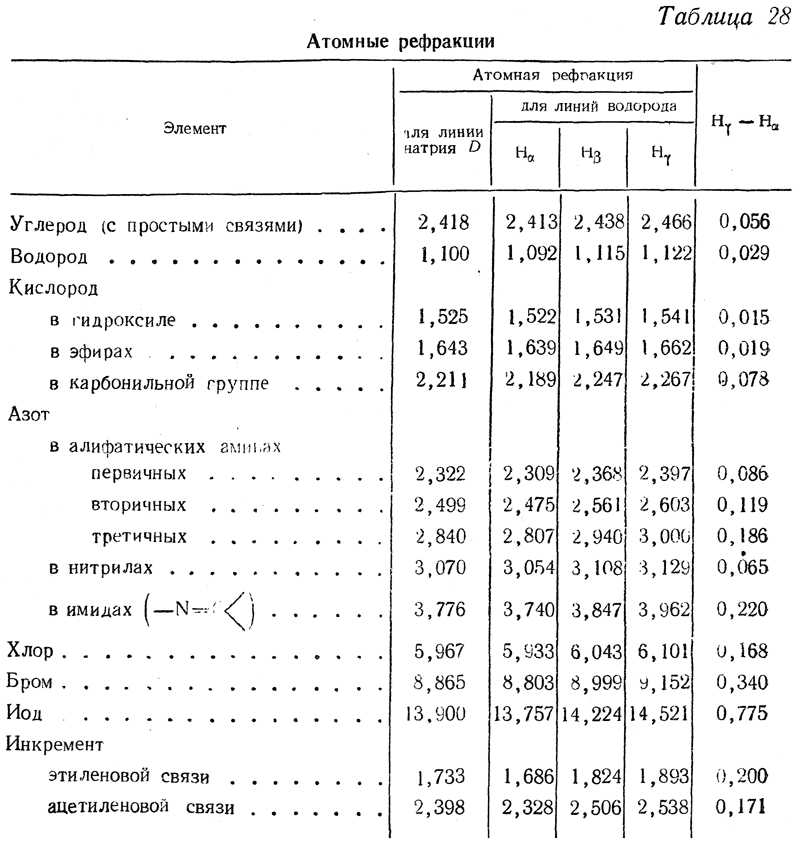
Исследования Ландольта, Брюля и Канноникова показали, что молекулярная рефракция органических веществ, так же как и молекулярный объем, может быть выражена суммой величин атомных рефракций, изменяющихся на определенную величину в зависимости от характера связей атомов Так, например, атомная рефракция углерода (для желтой линии D натрия), равная 2,418, при условии, что атом углерода связан с другими атомами лишь простыми связями, увеличивается на определенную величину, если этот атом связан с другим углеродным атомом кратной связью. При наличии в молекуле кратных связей к молекулярной рефракции, вычисленной из атомных рефракций, добавляют соответствующий инкремент на каждую кратную связь. Для ацетиленовой связи этот инкремент больше, чем для этиленовой.
Чаще всего рефракция определяется для желтой линии D натрия; очень часто она определяется также для линий водорода Нα, Hβ и Нγ. В настоящее время имеется несколько систем величин атомных рефракций, созданных разными исследователями на основании экспериментальных данных. Наиболее распространена система Рота и Эйзенлора (табл. 28).
Величины атомных и групповых рефракций для линии D натрия по определениям других авторов приведены ниже:

Величина Нγ—Нα (см. табл. 28), называемая молекулярным светорассеянием или молекулярной дисперсией света, также является характерной величиной для определения состава и строения органических веществ.
Многие значения атомных рефракций остаются постоянными в органических соединениях разных классов. Поэтому сравнение найденной молекулярной рефракции соединения, состав и молекулярный вес которого известны, с молекулярной рефракцией, вычисленной из атомных рефракций, часто дает представление о строении соединения, а иногда позволяет решить, каким из известных изомеров принадлежат те или иные возможные формулы. Для этого достаточно измерить показатель преломления и плотность вещества. Часто величина молекулярной рефракции позволяет судить о чистоте соединения с известным строением.
Как показывает опыт, инкременты кратных связей не всегда сохраняют постоянные значения. Сравнительно небольшие изменения строения (перемещения двойных связей друг относительно друга) могут вызывать изменения этих инкрементов, называемые экзальтацией. Так, например, экзальтацию молекулярной рефракции вызывает присутствие в молекуле сопряженных кратных связей.
Таким образом, по наличию или отсутствию экзальтации можно судить о взаимном расположении кратных связей в молекуле.
Удельную и молекулярную рефракцию твердых веществ можно определять в растворах.
Для определения удельной рефракции пользуются соотношением
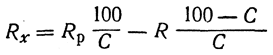
где Rx — искомая удельная рефракция растворенного вещества;
С — процентное содержание его в растворе: Rр и R — удельная рефракция раствора и чистого растворителя.
Умножив найденную удельную рефракцию твердого вещества на его молекулярный вес, находят молекулярную рефракцию.
Молекулярная рефракция является непосредственной мерой поляризуемости молекулы, т. е. подвижности зарядов под влиянием внешнего электрического поля (возбуждение светом, электрическим полем другой молекулы и т. д.).
Зависимость между поляризуемостью и молекулярной рефракцией выражается уравнением
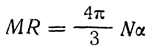
где MR — молекулярная рефракция: N — число Авогадро; α — поляризуемость.
Знание поляризуемости имеет самое существенное значение не только для характеристики строения молекулы, но и для понимания течения химических реакций.