Квантово-механические представления о строении электронной оболочки атома углерода
Согласно принципам квантовой механики, состояние электрона в атоме характеризуется четырьмя так называемыми квантовыми числами: п, l, т и s, где п — главное квантовое число, в основном определяющее энергию электрона; l — орбитальное (побочное) квантовое число, характеризующее момент количества движения электрона; т — магнитное квантовое число, характеризующее проекцию момента количества движения электрона на некоторое выделенное направление, а именно — направление внешнего магнитного поля; s — спиновое квантовое число, характеризующее некоторый дополнительный момент количества движения электрона, присущий самому электрону. На квантовые числа l, т и s накладываются следующие ограничения: l не может быть больше, чем главное квантовое число минус единица; т может принимать 2l +1 различных значений
от —l до +l; s может принимать только два значения:
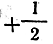
и
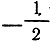
Кроме того, строение электронной оболочки многоэлек-
тронного атома таково, что всегда выполняется принцип Паули, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковы; иными словами, в атоме не может быть двух электронов, совершенно одинаковых по всем параметрам.
Число возможных различных значений l и т (не говоря о s, которое может всегда иметь только два значения) при заданном п видно из таблицы:
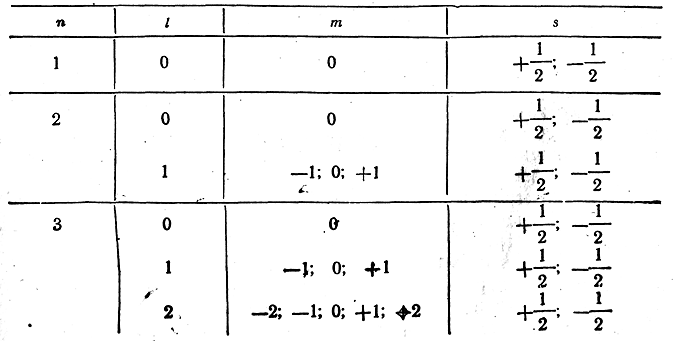
Из приведенной таблицы видно, что в атоме могут быть лишь два электрона с п=1, восемь с п=2, восемнадцать с п=3 и вообще 2п2 электронов с данным главным квантовым числом n.
Общепринято следующее условное обозначение электронов: значение главного квантового числа п указывается впереди цифрой (или буквой К, L, М, N и т. д.), а орбитальные квантовые числа l, равные 0, 1, 2, 3 и т. д., обозначаются буквами соответственно s, р, d, f и т. д. Число электронов, имеющих одинаковые значения п и l (а следовательно, разные т и s), указывается цифрой, которая записывается как показатель степени. Так, электрон атома водорода, для которого п = 1 и l = 0, записывается в виде 1s, электронная оболочка атома гелия, состоящая из двух электронов с одинаковыми пиl (п = 1, l = 0), записывается в виде 1s2. Электронная оболочка лития состоит из трех электронов: два из них такие же, как и у атома гелия (n = 1, l = 0), а третий характеризуется главным квантовым числом n = 2 и орбитальным l = 0. Поэтому электронная оболочка лития записывается в виде 1s22s.
Следуя этому принципу, можно записать строение электронных оболочек атомов, составляющих два первых периода периодической системы Д. И. Менделеева, следующим образом:

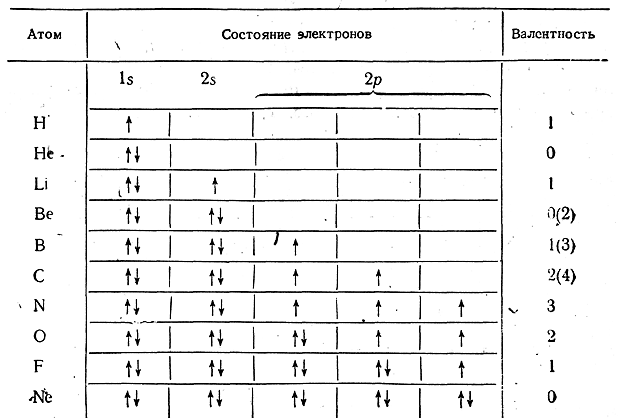
Можно также схематически представить распределение электронов в атомах по энергетическим уровням, размещая стрелки, изображающие электроны, в клетках, обозначающих возможные состояния этих электронов (1s, 2s, 2р и т. д.). Отличие в спинах электронов изображается различным направлением стрелок. Согласно принципу Паули, в каждой клетке могут быть два электрона только с антипараллельными спинами.
Как видно из таблицы, соответственно числу неспаренных электронов водород, литий и фтор одновалентны, азот трехвалентен, кислород двухзалентен, что согласуется с опытом и квантовой теорией валентности. Все электроны атомов гелия и неона спарены, что также вполне согласуется с инертностью этих атомов. В случае бериллия, бора и углерода полученные таким путем числа валентности противоречат опыту (истинные валентности указаны в скобках).
Для органической химии в первую очередь представляет интерес случай углерода. Двухвалентный углерод, возбуждаясь, превращается в четырехвалентный:

Возможность этого процесса, связанного с большой затратой энергии (161,5 ккал/моль), объясняется тем обстоятельством, что такая затрата энергии с избытком компенсируется при образовании двух новых связей четырехвалентного углерода (186 ккал/моль).
Следует отметить, что приведенное выше рассуждение о возбуждении углерода и превращении его из двухвалентного в четырехвалентный имеет существенное значение только для наглядности, так как оно (позволяет устранить кажущееся противоречие с опытом. Расчленение процесса (сначала возбуждение, а затем образование дзух новых связей) является только условной схемой, поясняющей возможность образования четырех связей атома углерода.
Химик всегда имеет дело с углеродом в первом, втором или третьем валентном состояниях, которые условно считаются состояниями четырехвалентного углерода, даже если это элементарный углерод в виде графита или алмаза.
При рассмотрении атома углерода с позиций квантовой механики, на первый взгляд, возникает и другое затруднение. Дело в том, что электронные облака s- и р-электронов имеют различную пространственную конфигурацию: электронное облако s-электрона имеет форму шара, а облако р-электрона — форму объемной восьмерки (рис. 7, А, Б):
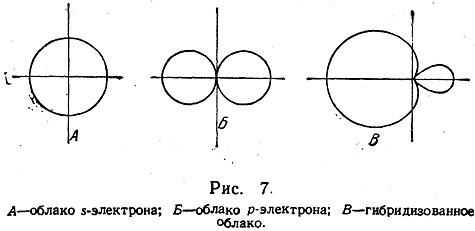
Легко видеть, что четыре связи возбужденного атома углерода 1s22s2p3 с другими атомами должны образоваться за счет трех р-электронов и одного s-электрона, а следовательно, одна из валентных связей по своей пространственной конфигурации должна отличаться от трех остальных, что противоречит всему опыту органической химии. При помощи квантовой механики было, однако, показано, что в действительности облака трех р-электронов и одного s-электрона углерода «гибридизуются» разными способами (см. ниже), например образуются четыре одинаковых «гибридизованных» облака (рис. 7, В), направленных из центра правильного тетраэдра к его вершинам. Такая гибридизация обозначается как sр3-гибридизация.
Предыдущая страница |
Сдедующая страница
СОДЕРЖАНИЕ