Химический потенциал
Химический потенциал (mi), термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из i компонентов, химический потенциал определяется как приращение внутренней энергии U системы при добавлении к системе бесконечно малого количества молей i-того компонента, отнесённое к этому количеству вещества, при постоянных объёме V, энтропии S и количествах молей каждого из остальных компонентов nj (j ¹ i). В общем случае химический потенциал может быть определён как приращение любого из остальных потенциалов термодинамических системы при различных постоянных параметрах: гиббсовой энергии G — при постоянных давлении р, температуре Т и nj; гельмгольцевой энергии А — при постоянных V, Т и nj; энтальпии Н — при постоянных S, р и nj. Таким образом:
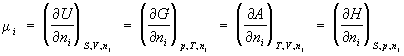 (1)
(1)
Химический потенциал зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае — смеси идеальных газов — mi зависит лишь от концентрации рассматриваемого компонента и от температуры:
mi = mi 0+ RT In pi,
где pi — парциальное давление компонента i в смеси, R — газовая постоянная, mi0 — значение mi при pi = 1 атм. Для смеси неидеальных газов в равенстве (2) должна стоять фугитивность этого компонента. Химический потенциал характеризует способность рассматриваемого компонента к выходу из данной фазы (путём испарения, растворения, кристаллизации, химического взаимодействия и т.д.). В многофазных (гетерогенных) системах переход данного компонента может происходить самопроизвольно только из фазы, в которой его химический потенциал больше, в фазу, для которой его химический потенциал меньше. Такой переход сопровождается уменьшением химического потенциала этого компонента в 1-й фазе и увеличением во 2-й. В результате разность между химическими потенциалами данного компонента в этих двух фазах уменьшается и при достижении равновесия химический потенциал компонента становится одинаковым в обеих фазах. В любой равновесной гетерогенной системе химический потенциал каждого компонента одинаков во всех фазах.
Если в различных фазах или в разных местах одной фазы химический потенциал какого-либо компонента неодинаков, то в системе самопроизвольно (без затраты энергии извне) происходит перераспределение частиц, сопровождающееся выравниванием химического потенциала.
Из условий термодинамического равновесия систем, в которых возможны химические реакции, фазовые переходы и др. процессы перераспределения частиц, и уравнения, учитывающего баланс частиц, вытекают важнейшие термодинамические соотношения: действующих масс закон, фаз правило Дж. У. Гиббса, основные законы разбавленных растворов (см. Вант-Гоффа закон, Рауля законы, Генри закон и др.) и т.д.
Химический потенциал в качестве нормировочной постоянной входит в распределение Больцмана, а также в распределения по энергиям Бозе — Эйнштейна и Ферми — Дирака для частиц идеального газа (см. Статистическая физика). Химический потенциал вырожденного газа электронов (ферми-газа) тождественно совпадает с граничной ферми энергией.
Химический потенциал был введён Гиббсом, численно выражается в единицах энергии на единицу количества вещества (дж/моль) или на единицу массы (дж/кг).
Лит. см. при статьях Термодинамика, Статистическая физика.
И. А. Кузнецов.