Атом
АТОМ (от греч. atomos - неделимый), наименьшая частица хим. элемента, носитель его св-в. Каждому хим. элементу соответствует совокупность определенных атомов. Связываясь друг с другом, атомы одного или разных элементов образуют более сложные частицы, напр. молекулы. Все многообразие хим. в-в (твердых, жидких и газообразных) обусловлено разл. сочетаниями атомов между собой. Атомы могут существовать и в своб. состоянии (в газе, плазме). Св-ва атома, в т. ч. важнейшая для химии способность атома образовывать хим. соед., определяются особенностями его строения.
Общая характеристика строения атома. Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами _ядра атома (линейные размеры атома ~ 10~8см, его ядра ~ 10" -10" 13 см). Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значит. степени условны и зависят от способов их определения (см. Атомные радиусы). Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами (см. Ядро атомное). Положит. заряд протона и отрицат. заряд электрона одинаковы по абс. величине и равны е= 1,60*10-19 Кл; нейтрон не обладает элек-трич. зарядом. Заряд ядра +Ze - осн. характеристика атома, обусловливающая его принадлежность к определенному хим. элементу. Порядковый номер элемента в периодич. системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном атоме число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соотв. в положит. или отрицат. ион, напр. Li+, Li2+ или О-, О2-. Говоря об атомах определенного элемента, подразумевают как нейтральные атомы, так и ионы этого элемента.
Масса атома определяется массой его ядра; масса электрона (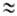 9,109*10-28
г) примерно в 1840 раз меньше массы протона или нейтрона (
9,109*10-28
г) примерно в 1840 раз меньше массы протона или нейтрона (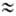 1,67*10-24 г), поэтому вклад электронов в массу атома незначителен.
Общее число протонов и нейтронов А = Z + N наз. массовым числом.
Массовое число и заряд ядра указываются соотв. верхним и нижним индексами
слева от символа элемента, напр. 2311Na. Вид атомов
одного элемента с определенным значением N наз. нуклидом. Атомы одного
и того же элемента с одинаковыми Z и разными N наз. изотопами этого
элемента. Различие масс изотопов мало сказывается на их хим. и физ. св-вах.
Наиболее значит, отличия (изотопные эффекты)наблюдаются у изотопов
водорода вследствие большой относит. разницы в массах обычного атома
1,67*10-24 г), поэтому вклад электронов в массу атома незначителен.
Общее число протонов и нейтронов А = Z + N наз. массовым числом.
Массовое число и заряд ядра указываются соотв. верхним и нижним индексами
слева от символа элемента, напр. 2311Na. Вид атомов
одного элемента с определенным значением N наз. нуклидом. Атомы одного
и того же элемента с одинаковыми Z и разными N наз. изотопами этого
элемента. Различие масс изотопов мало сказывается на их хим. и физ. св-вах.
Наиболее значит, отличия (изотопные эффекты)наблюдаются у изотопов
водорода вследствие большой относит. разницы в массах обычного атома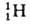 (протия), дейтерия D
(протия), дейтерия D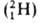 и трития Т
и трития Т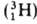 .
Точные значения масс атомов определяют методами масс-спектрометрии.
.
Точные значения масс атомов определяют методами масс-спектрометрии.
Квантовые состояния атома. Благодаря малым размерам и большой массе
ядро атома можно приближенно считать точечным и покоящимся в центре масс атома
и рассматривать атом как систему электронов, движущихся вокруг неподвижного
центра - ядра. Полная энергия такой системы Е равна сумме кинетич.
энергий Т всех электронов и потенциальной энергии U, к-рая складывается
из энергии притяжения электронов ядром и энергии взаимного отталкивания
электронов друг от друга. Атом подчиняется законам квантовой механики; его
осн. характеристика как квантовой системы - полная энергия Е - может
принимать лишь одно из значений дискретного ряда Е1 <
Е2 < Е3 < ...; промежут. значениями энергии
атом обладать не может. Каждому из "разрешенных" значений Е соответствует
одно или неск. стационарных (с не изменяющейся во времени энергией) состояний
атома. Энергия Е может изменяться только скачкообразно - путем квантового
перехода атома из одного стационарного состояния в другое. Методами квантовой
механики можно точно рассчитать Е для одноэлектронных атомов - водорода
и водородоподобных: Е= —hcRZ2/n2, где h
- постоянная Планка, с-скорость света, целое число п =
1, 2, 3, ... определяет дискретные значения энергии и наз. главным квантовым
числом; R-постоянная Ридберга (hcR = 13,6 эВ). При использовании
СИ ф-ла для выражения дискретных уровней энергии одноэлектронных атомов записывается
в виде:
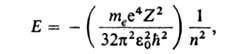
где те- масса электрона,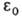 -электрич.
постоянная,
-электрич.
постоянная,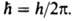 Возможные "разрешенные" значения энергии электронов в атоме изображают в виде
схемы уровней энергии - горизонтальных прямых, расстояния между к-рыми
соответствуют разностям этих значений энергий (рис. 1). наиб. низкий уровень
E1, отвечающий минимально возможной энергии, наз. основным,
все остальные - возбужденными. Аналогично наз. состояния (основное и возбужденныеХ
к-рым соответствуют указанные уровни энергии. С ростом п уровни
сближаются и при
Возможные "разрешенные" значения энергии электронов в атоме изображают в виде
схемы уровней энергии - горизонтальных прямых, расстояния между к-рыми
соответствуют разностям этих значений энергий (рис. 1). наиб. низкий уровень
E1, отвечающий минимально возможной энергии, наз. основным,
все остальные - возбужденными. Аналогично наз. состояния (основное и возбужденныеХ
к-рым соответствуют указанные уровни энергии. С ростом п уровни
сближаются и при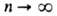 энергия электрона приближается к значению, отвечающему своб. (покоящемуся)
электрону, удаленному из атома. Квантовое состояние атома с энергией Е полностью
описывается волновой ф-цией
энергия электрона приближается к значению, отвечающему своб. (покоящемуся)
электрону, удаленному из атома. Квантовое состояние атома с энергией Е полностью
описывается волновой ф-цией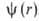 ,
где r-радиус-вектор электрона относительно ядра. Произведение
,
где r-радиус-вектор электрона относительно ядра. Произведение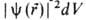 равно вероятности нахождения электрона в объеме dV, то есть
равно вероятности нахождения электрона в объеме dV, то есть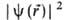 -плотность вероятности (электронная плотность). Волновая ф-ция
-плотность вероятности (электронная плотность). Волновая ф-ция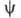 определяется уравнением Шрёдингера
определяется уравнением Шрёдингера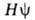 =
=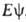 ,
где R-оператор полной энергии (гамильтониан).
,
где R-оператор полной энергии (гамильтониан).
Наряду с энергией движение электрона вокруг ядра (орбитальное движение)
характеризуется орбитальным моментом импульса (орбитальным мех. моментом)
М1; квадрат его величины может принимать значения, определяемые
орбитальным квантовым числом l = 0, 1, 2, ...;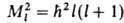 , где
, где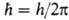 . При
заданном и квантовое число l может принимать значения от 0 до (и — 1).
Проекция орбитального момента на нек-рую ось z также принимает дискретный
ряд значений Мlz =
. При
заданном и квантовое число l может принимать значения от 0 до (и — 1).
Проекция орбитального момента на нек-рую ось z также принимает дискретный
ряд значений Мlz =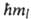 ,
где ml-магнитное квантовое число, имеющее дискретные значения
от — l до +l(-l,... - 1, О, 1, ... + l), всего 2l + 1 значений.
Ось z для атома в отсутствие внеш. сил выбирается произвольно, а в магн. поле
совпадает с направлением вектора напряженности поля. Электрон обладает
также собственным моментом импульса -спином и связанным с ним спиновым
магн. моментом. Квадрат спинового мех. момента МS2
=
,
где ml-магнитное квантовое число, имеющее дискретные значения
от — l до +l(-l,... - 1, О, 1, ... + l), всего 2l + 1 значений.
Ось z для атома в отсутствие внеш. сил выбирается произвольно, а в магн. поле
совпадает с направлением вектора напряженности поля. Электрон обладает
также собственным моментом импульса -спином и связанным с ним спиновым
магн. моментом. Квадрат спинового мех. момента МS2
=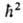 S(S +
+ 1) определяется спиновым квантовым числом S = 1/2, а проекция
этого момента на ось z Msz = =
S(S +
+ 1) определяется спиновым квантовым числом S = 1/2, а проекция
этого момента на ось z Msz = =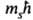 -квантовым
числом ms, принимающим полуцелые значения ms=1/2
и ms = -1/2.
-квантовым
числом ms, принимающим полуцелые значения ms=1/2
и ms = -1/2.
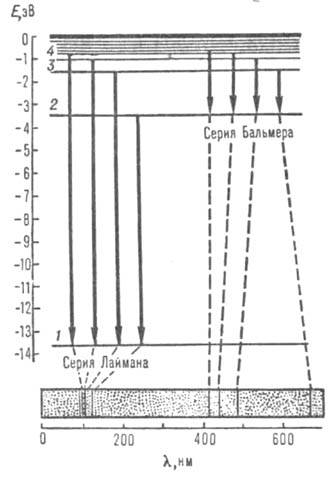
Рис. 1. Схема уровней энергии атома водорода (горизонтальные линии) и оптич. переходов (вертикальные линии). Внизу изображена часть атомного спектра испускания водорода - две серии спектральных линий; пунктиром показано соответствие линий и переходов электрона.
Стационарное состояние одноэлектронного атома однозначно характеризуется
четырьмя квантовыми числами: п, l, ml и ms. Энергия
атома водорода зависит только от п, и уровню с заданным п соответствует
ряд состояний, отличающихся значениями l, ml, ms.
Состояния с заданными п и l принято обозначать как 1s, 2s, 2p,
3s и т.д., где цифры указывают значения л, а буквы s, p, d, f и
дальше по латинскому алфавиту соответствуют значениям д = 0, 1, 2,
3, ... Число разл. состояний с заданными п и д равно 2(2l+ 1) числу
комбинаций значений ml и ms. Общее число разл. состояний
с заданным п равно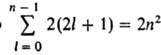 , т. е. уровням со значениями п = 1, 2, 3, ... соответствуют 2,
8, 18, ..., 2n2 разл. квантовых состояний. Уровень, к-рому соответствует
лишь одно квантовое состояние (одна волновая ф-ция), наз. невырожденным.
Если уровню соответствует два или более квантовых состояний, он наз. вырожденным
(см. Вырождение энергетических уровней). В атоме водорода уровни энергии
вырождены по значениям l и ml; вырождение по ms имеет
место лишь приближенно, если не учитывать взаимод. спинового магн. момента
электрона с магн. полем, обусловленным орбитальным движением электрона
в электрич. поле ядра (см. Спин-орбитальное взаимодействие). Это
- релятивистский эффект, малый в сравнении с кулоновским взаимод., однако
он принципиально существен, т.к. приводит к дополнит. расщеплению уровней
энергии, что проявляется в атомных спектрах в виде т. наз. тонкой структуры.
, т. е. уровням со значениями п = 1, 2, 3, ... соответствуют 2,
8, 18, ..., 2n2 разл. квантовых состояний. Уровень, к-рому соответствует
лишь одно квантовое состояние (одна волновая ф-ция), наз. невырожденным.
Если уровню соответствует два или более квантовых состояний, он наз. вырожденным
(см. Вырождение энергетических уровней). В атоме водорода уровни энергии
вырождены по значениям l и ml; вырождение по ms имеет
место лишь приближенно, если не учитывать взаимод. спинового магн. момента
электрона с магн. полем, обусловленным орбитальным движением электрона
в электрич. поле ядра (см. Спин-орбитальное взаимодействие). Это
- релятивистский эффект, малый в сравнении с кулоновским взаимод., однако
он принципиально существен, т.к. приводит к дополнит. расщеплению уровней
энергии, что проявляется в атомных спектрах в виде т. наз. тонкой структуры.
При заданных n, l и ml квадрат модуля волновой ф-ции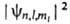 определяет для электронного облака в атоме среднее распределение электронной
плотности. Разл. квантовые состояния атома водорода существенно отличаются
друг от друга распределением электронной плотности (рис. 2). Так, при l
= 0 (s-состояния) электронная плотность отлична от нуля в центре атома и не
зависит от направления (т.е. сферически симметрична), для остальных состояний
она равна нулю в центре атома и зависит от направления.
определяет для электронного облака в атоме среднее распределение электронной
плотности. Разл. квантовые состояния атома водорода существенно отличаются
друг от друга распределением электронной плотности (рис. 2). Так, при l
= 0 (s-состояния) электронная плотность отлична от нуля в центре атома и не
зависит от направления (т.е. сферически симметрична), для остальных состояний
она равна нулю в центре атома и зависит от направления.

Рис. 2. Форма электронных облаков для различных состояний атома водорода.
В многоэлектронных атомах вследствие взаимного электростатич. отталкивания
электронов существенно уменьшается прочность их связи с ядром. Напр., энергия
отрыва электрона от иона Не+ равна 54,4 эВ, в нейтральном атоме
Не она значительно меньше - 24,6 эВ. Для более тяжелых атомов связь внеш. электронов
с ядром еще слабее. Важную роль в многоэлектронных атомах играет специфич.
обменное взаимодействие, связанное с неразличимостью электронов,
и тот факт, что электроны подчиняются Паули принципу, согласно к-рому
в каждом квантовом состоянии, характеризуемом четырьмя квантовыми числами,
не может находиться более одного электрона. Для многоэлектронного атома имеет
смысл говорить только о квантовых состояниях всего атома в целом. Однако приближенно,
в т. наз. одноэлектронном приближении, можно рассматривать квантовые состояния
отдельных электронов и характеризовать каждое одноэлектронное состояние
(определенную орбиталъ, описываемую соответствующей ф-цией) совокупностью
четырех квантовых чисел n, l, ml и ms. Совокупность
2(2l+ 1) электронов в состоянии с данными п и l образует электронную
оболочку (наз. также подуровнем, подоболочкой); если все эти состояния
заняты электронами, оболочка наз. заполненной (замкнутой). Совокупность
2п2 состояний с одним и тем же n, но разными l образует
электронный слой (наз. также уровнем, оболочкой). Для п= 1, 2, 3,
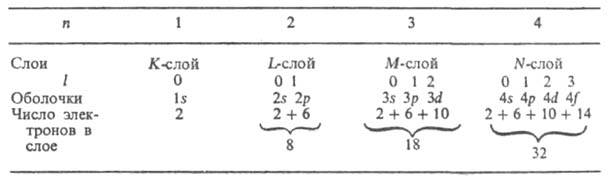
4, ... слои обозначают символами К, L, M, N, ... Число электронов
в оболочках и слоях при полном заполнении приведены в таблице:
Прочность связи электрона в атоме, т. е. энергия, к-рую необходимо сообщить
электрону, чтобы удалить его из атома, уменьшается с увеличением п, а при
данном п - с увеличением l. Порядок заполнения электронами оболочек
и слоев в сложном атоме определяет его электронную конфигурацию, т.е. распределение
электронов по оболочкам в основном (невозбужденном) состоянии этого атома
и его ионов. При таком заполнении последовательно связываются электроны
с возрастающими значениями и и /. Напр., для атома азота (Z = 7) и его ионов
N+, N2+, N3+, N4+, N5+
и N6+ электронные конфигурации имеют вид соотв.: Is22s22p3;
Is22s22p2; Is22s22p;
Is22s2; Is22s; Is2; Is (число
электронов в каждой оболочке указывается индексом справа сверху). Такие
же электронные конфигурации, как и у ионов азота, имеют нейтральные атомы
элементов с тем же числом электронов: С, В, Be, Li, He, Н (Z = 6, 5, 4,
3, 2, 1). Начиная с n = 4 порядок заполнения оболочек изменяется: электроны
с большим п, но меньшим l оказываются связанными прочнее, чем электроны
с меньшим п и большим l (правило Клечковского), напр. 4s-электроны
связаны прочнее 3d-электронов, и сперва заполняется оболочка 4s, а затем
3d. При заполнении оболочек 3d, 4d, 5d получаются группы
соответствующих переходных элементов; при заполнении 4f- и 5f-оболочек
- соотв. лантаноиды и актиноиды. Порядок заполнения обычно соответствует
возрастанию суммы квантовых чисел (п + l); при равенстве
этих сумм для двух или более оболочек сначала заполняются оболочки с меньшим
и. Имеет место след. последовательность заполнения электронных оболочек:
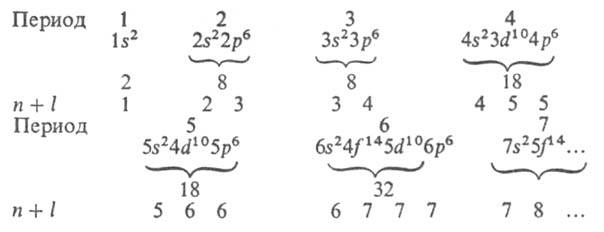
Для каждого периода указаны электронная конфигурация благородного газа, макс. число электронов, а в последней строке приведены значения п + l. Имеются, однако, отступления от этого порядка заполнения (подробнее о заполнении оболочек см. Периодическая система химических элементов).
Между стационарными состояниями в атоме возможны квантовые переходы. При переходе с более высокого уровня энергии Еi на более низкий Ek атом отдает энергию (Ei — Ek), при обратном переходе получает ее. При излучательных переходах атом испускает или поглощает квант электромагн. излучения (фотон). Возможны и безызлучательные переходы, когда атом отдает или получает энергию при взаимод. с др. частицами, с к-рыми он сталкивается (напр., в газах) или длительно связан (в молекулах, жидкостях и твердых телах). В атомарных газах в результате столкновения своб. атома с др. частицей он может перейти на др. уровень энергии - испытать неупругое столкновение; при упругом столкновении изменяется лишь кинетич. энергия постулат. движения атома, а его полная внутр. энергия Е остается неизменной. Неупругое столкновение своб. атома с быстро движущимся электроном, отдающим этому атому свою кинетич. энергию, - возбуждение атома электронным ударом - один из методов определения уровней энергии атома.
Строение атома и свойства веществ. Хим. св-ва определяются строением внеш. электронных оболочек атомов, в к-рых электроны связаны сравнительно слабо (энергии связи от неск. эВ до неск. десятков эВ). Строение внеш. оболочек атомов хим. элементов одной группы (или подгруппы) периодич. системы аналогично, что и обусловливает сходство хим. св-в этих элементов. При увеличении числа электронов в заполняющейся оболочке их энергия связи, как правило, увеличивается; наиб. энергией связи обладают электроны в замкнутой оболочке. Поэтому атомы с одним или неск. электронами в частично заполненной внеш. оболочке отдают их в хим. р-циях. Атомы, к-рым не хватает одного или неск. электронов для образования замкнутой внеш. оболочки, обычно принимают их. Атомы благородных газов, обладающие замкнутыми внеш. оболочками, при обычных условиях не вступают в хим. р-ции.
Строение внутр. оболочек атомов, электроны к-рых связаны гораздо прочнее (энергия связи 102-104 эВ), проявляется лишь при взаимод. атомов с быстрыми частицами и фотонами высоких энергий. Такие взаимод. определяют характер рентгеновских спектров и рассеяние частиц (электронов, нейтронов) на атомах (см. Дифракционные методы). Масса атома определяет такие его физ. св-ва, как импульс, кинетич. энергия. От механических и связанных с ними магн. и электрич. моментов ядра атома зависят нек-рые тонкие физ. эффекты (ЯМР, ЯКР, сверхтонкая структура спектральных линий, см Спектроскопия).
Более слабые по сравнению с хим. связью электростатич. взаимод. двух атомов проявляются в их взаимной поляризуемости - смещении электронов относительно ядер и возникновении поляризац. сил притяжения между атомами (см. Межмолекулярные взаимодействия). Атом поляризуется и во внеш. электрич. полях; в результате уровни энергии смещаются и, что особенно важно, вырожденные уровни расщепляются (см. Штарка эффект). Атом может поляризоваться также под действием электрич. поля волны электромагн. излучения; поляризация зависит от частоты излучения, что обусловливает зависимость от нее показателя преломления в-ва, связанного с поляризуемостью атома. Тесная связь оптич. св-в атома с его электрич. св-вами особенно ярко проявляется в оптич. спектрах.
Внеш. электроны атома определяют и магн. св-ва в-ва. В атоме с заполненными внеш. оболочками его магн. момент, как и полный момент импульса (мех. момент), равен нулю. Атом с частично заполненными внеш. оболочками обладают, как правило, постоянными магн. моментами, отличными от нуля; такие в-ва парамагнитны (см. Парамагнетики). Во внеш. магн. поле все уровни энергии атомов, для к-рых магн. момент не равен нулю, расщепляются (см. Зеемана эффект). Все атомы обладают диамагнетизмом, к-рый обусловлен возникновением у них индуцированного магн. момента под действием внеш. магн. поля (см. Диэлектрики).
Св-ва атома, находящегося в связанном состоянии (напр., входящего в состав молекул), отличаются от св-в своб. атома. Наиб. изменения претерпевают св-ва, определяемые внеш. электронами, принимающими участие в хим. связи; св-ва, определяемые электронами внутр. оболочек, могут при этом практически не изменяться. Нек-рые св-ва атома могут испытывать изменения, зависящие от симметрии окружения данного атома. Примером может служить расщепление уровней энергии атомов в кристаллах и комплексных соед., к-рое происходит под действием электрич. полей, создаваемых окружающими ионами или лигандами.
===
Исп. литература для статьи «АТОМ»: Карапетьянц М. X., Дракин С.И., Строение вещества, 3 изд.,
М., 1978; Шло лье кий Э. В., Атомная физика, 7 изд., т. 1-2, М., 1984.
М. А. Ельяшевич.
Страница «АТОМ» подготовлена по материалам химической энциклопедии.