Главные задачи синтеза
Итак, синтез природных углеводных структур и их ближайших аналогов. В первую очередь, это синтез моносахаридов, природных гликозидов, олигосахаридов и полисахаридов. Олиго- и полисахариды, как мы помним, построены из остатков моносахаридов, соединенных О-гликозидными связями. В природных гликозидах с тем же типом связи моносахаридные остатки соединены с неуглеводными агликонами. Поэтому в синтезе олиго- и полисахаридов или гликозидов задача химика сводится в конечном итоге к тому, чтобы соединить моносахаридные остатки друг и другом или с агликоном гликозидными связями.
Таким образом, в синтезе природных углеводов и их аналогов можно выделить две общие и наиболее фундаметальные проблемы: синтез моносахаридов и построение гликозидных связей.
В понимании химика XIX в. «синтезировать органическое соединение» означало получить его искусственно из наиболее простого сырья, в идеале – из элементов. Даже если исходными служили другие органические соединения (например, уксусная кислота или этилен), конечный результат также мог рассматриваться как полный синтез, т.е. синтез из элементов, поскольку способы получения этих исходных соединений из элементов уже существовали. В современном тонком органическом синтезе исследователь, как правило, не задумывается о том, насколько далеко отстоят используемые им исходные соединения. Важно только, чтобы эти исходные соединения были достаточно доступны: производились промышленностью, либо, по крайней мере, чтобы способы их получения (необязательно путем синтеза) были описаны в литературе ранее. Отсюда понятно, что при синтезе олигосахаридов, полисахаридов и гликозидов основными исходными соединениями служат составляющие их моносахариды и их подходящие производные. Что же касается синтеза самих моносахаридов, то его общие принципы заслуживают специального обсуждения.
Построение характерного для большинства моносахаридов прямого углеродного скелета из пяти-шести углеродных атомов не составляет проблемы для современной органической химии. Несколько сложнее, но также вполне в пределах синтетических возможностей, снабдить каждый из этих атомов функциональной группой – спиртовой, аминогруппой, карбонильной и т.д. Еще Бутлеров более 100 лет назад осуществил синтез смеси моносахаридов с присущей им бутлеровской структурой, использовав одно из простейших органических соединений – формальдегид. Загвоздка, однако, заключается в том, что большинство углеродных атомов моносахаридной молекулы асимметрично. Поэтому синтез природного моносахарида предполагает не только создание нужного углеродного скелета, но и возможность придания всем асимметрическим центрам вполне определенной относительной и абсолютной конфигурации. А такая задача весьма трудна даже для современной высокоразвитой органической химии, если в качестве исходных соединений используются простые молекулы без элементов асимметрии или даже более сложные системы, содержащие один-два асимметричных центра с нужной конфигурацией.
Поэтому гораздо более простым и эффективным оказывается такой путь: проведение совокупности последовательных трансформаций доступных моносахаридов, целенаправленно приводящее к другому моносахариду с желаемой структурой. Доступными (выпускаемыми промышленностью) моносахаридами, чаще всего используемыми в качестве исходных соединений в таких синтезах, являются D-глюкоза, D-галактоза, D-манноза, D- и L-арабиноза, D-ксилоза, N-ацетил-D-глюкозамин, D-фруктоза, D-рибоза и немногие другие. Следующие несколько примеров могут проиллюстрировать такие «трансформационные» принципы синтеза.
Для получения D-глюкуроновой кислоты (1) из D-глюкозы (2) необходимо окислить CH 2 OH-группу до карбоксила; чтобы получить 4-О-метил-D-глюкуроновую кислоту (3), нужно, кроме того, прометилировать гидроксил при С-4; для синтеза 3-амино-3-дезокси-D-глюкозы (4) – заменить гидроксильную группу при С-3 на аминогруппу. Для синтеза 2-дезокси-D-рибозы (5) из D-рибозы (6) или D-арабинозы (7), или для синтеза D-фукозы (8) из D-галактозы (9) необходимо в исходном моносахариде удалить соответствующую гидроксильную группу. Синтез D-ликсозы (10) из D-ксилозы (11) требует обращения конфигурации одного асимметричного центра при C-2, а из D-арабинозы (7) – при С-3 и т.п.
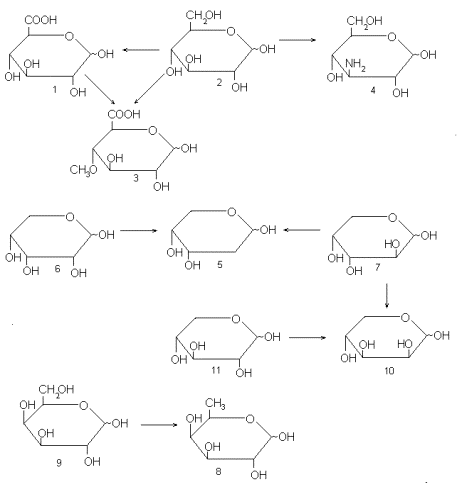
Не следует думать, что наиболее удобный путь синтеза – это всегда минимальная трансформация исходного соединения. В этом смысле приведенные схемы нужно рассатривать только как наглядную иллюстрацию принципи. Тем не менее они содержат примеры основных типов трансформаций, используемых в реальных синтезах моносахаридов, таких, как окисление или восстановление одного из углеродных атомов исходного моносахарида, замена гидроксила на иную функцию (аминогруппу, метокси-группу и т.п.), обращение конфигурации. Сюда можно добавить еще несколько типичных превращений: удлинение углеродной цепи, введение разветвлений, а также одновременное или последовательное выполнение нескольких подобных трансформаций. Химические реакции, приводящие к характерным для синтеза моносахаридов изменениям в структуре молекулы, относительно просты и применительно к простым органическим соединениям, выполняются обычно без особых затруднений.
Синтез моносахаридов из моносахаридных же предшественников удобен, разумеется, тем, что большая часть целевой структуры уже имеется в исходном соединении: весь углеродный скелет или, по крайней мере, его значительная часть, большинство функциональных групп, нужная конфигурация большинства асимметрических центров. Однако именно в этом и заключается главная трудность. Ведь для того, чтобы выполнить целенаправленную трансформацию, нужно суметь не затронуть другие, химически весьма близкие группировки в исходной молекуле. Например, при синтезе 4-О-метил-D-глюкуроновой кислоты (3) нужно тем или иным способом обеспечить метилирование именно четвертого гидроксила, а не весьма сходных с ним по химическим свойствам третьего или второго. Аналогично, для превращения D-ксилозы (11) в D-ликсозу (10) надо добиться обращения конфигурации углеродного атома С-2, несущего в пиранозной форме экваториальный вторичный гидроксил, и не затронуть при этом конфигурацию двух других центров (С-3 и С-4), также находящихся в пиранозном цикле и также связанных с экваториальными вторичными гидроксилами. Аналогичные задачи возникают в каждом из приведенных выше принципиальных синтетических путей и практически в каждом другом синтезе моносахаридов по схеме трансформаций.
Проблема обеспечения избирательности реакции при наличии в молекуле нескольких реакционных центров – проблема региоспецифичности (от латинского regio – область) – имеет в органической химии весьма общее значение, но особенно характерна именно для химии углеводов, небольшой углеродный скелет которых до предела насыщен однотипными функциональными группами, создающими вместе с гликозидным центром неповторимый и весьма колоритный ансамбль. Как же может быть решена задача?
Ключевым принципом, позволяющим добиваться высокой, даже абсолютной региоспецифичности таких реакций, является применение защитных групп. Этот подход настолько важен, что заслуживает специального рассмотрения.
Предыдущая страница |
Следующая страница
СОДЕРЖАНИЕ