Азотистая кислота
АЗОТИСТАЯ КИСЛОТА HNO2, бесцв. в-во, существующее в виде паров или водного р-ра. Нагревание паров или их конденсация, а также концентрирование водных р-ров приводят к разложению азотистой кислоты: в парах-по р-ции 2HNO2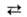 NO + NO2 + Н2О, в p-pe-3HNO2
NO + NO2 + Н2О, в p-pe-3HNO2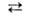
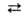 HNO3 + 2NO + Н2О. Сильные неорг. к-ты катализируют разложение. Азотистая кислота существует в двух таутомерных формах:
HNO3 + 2NO + Н2О. Сильные неорг. к-ты катализируют разложение. Азотистая кислота существует в двух таутомерных формах:
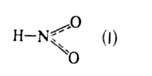
и НО—N=O (II), для каждой из к-рых известны свои ряды комплексных соед. и орг. производных, содержащих соотв. нитрогруппу NO2 и нитритогруппу ONO. При 298 К равновесная смесь содержит 0,309 мольных долей I и 0,691 мольных долей П. Для газообразных I и II С°р соотв. 45,4 и 46,0 Дж/(моль*К);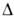 H°обр -77,4 и -79,5 кДж/моль,
H°обр -77,4 и -79,5 кДж/моль,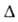 G°обр -42,6 и -44,6кДж/моль; S°298 249 Дж/(моль*К).
G°обр -42,6 и -44,6кДж/моль; S°298 249 Дж/(моль*К).
Азотистая кислота - одноосновная к-та средней силы; при 12,5°С рКа 3,37, степень диссоциации в 0,1 н. водном р-ре 6,5%. С основаниями образует соли-нитриты. Сильными окислителями (Н2О2, КМпО4 и др.) окисляется до HNO3. Восстанавливается до NO (под действием HI и др.), H2N2O2 (под действием NH2OH) или до смеси NO + N2O + + H2N202.
Получают азотистую кислоту действием неорг. к-т на нитриты; .применяют в орг. синтезе для получения солей диазония и др. cоединений. Э. Г. Раков.

Дополнения к описанию азотистой кислоты:
Ключевые свойства:
Практическое применение:
Интересные факты: