Вода
ВОДА (оксид водорода) Н2О, мол. м. 18,016, простейшее устойчивое соед. водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Распространение в природе. Вода - одно из самых распространенных на Земле соединений. Молекулы воды обнаружены в межзвездном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников. Кол-во воды на пов-сти Земли оценивается в 1,39*1018 т, большая часть ее содержится в морях и океанах. Кол-во доступных для использования пресных вод в реках, озерах, болотах и водохранилищах составляет 2*104 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4*1016т, примерно столько же имеется подземных вод, причем только небольшая их часть - пресные. В глубинных слоях Земли содержится значительно больше (повидимому, не менее, чем на порядок) воды, чем на пов-сти. В атмосфере находится ок. 1,3*1013 т воды. Вода входит в состав мн. минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязат. компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых изотопных разновидностей воды. Содержание их в пресной воде в среднем следующее (мол. %): 1Н216О - 99,13; 1Н218О - 0,2; 1Н2170-0,04; 1Н2О16О-0,03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных кол-вах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое кол-во радиоактивного 3Н2 (или Т2О). Изотопный состав природной воды разного происхождения неск. варьирует. Особенно непостоянно отношение 1Н/2Н: в пресных водах - в среднем 6900, в морской воде -5500, во льдах - 5500-9000. По физ. свойствам D2O заметно отличается от обычной воде (см. Тяжелая вода). Вода, содержащая 18О, по св-вам ближе к воде с 16О.
Строение молекулы и физические свойства. Атомы водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи О—Н 0,0957 нм; валентный угол Н—О—Н 104,5°; дипольный момент 6,17*10-30 Кл*м; поляризуемость молекулы 1,45*10-3 нм3; средний квадрупольный момент — 1,87*10-41 Кл*м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимод. молекулы воды с др. атомами, молекулами и ионами, в т.ч. с другими молекулами воды в конденсир. фазах, эти параметры изменяются.
Нек-рые параметры, характеризующие св-ва воды в разных агрегатных состояниях
при атм. давлении, приведены ниже (см. также табл. 1 и рис. 1, на к-ром
указаны области существования разл. модификаций льда):

Физ. свойства воды аномальны. Плавление льда при атм. давлении сопровождается
уменьшением объема на 9%. Температурный коэф. объемного расширения льда
и жидкой воды отрицателен при т-pax соотв. ниже -210°С и 3,98 °С. Теплоемкость
С° при плавлении возрастает почти вдвое и в интервале 0-100°С почти не
зависит от т-ры (имеется минимум при 35 °С). Минимум изо-термич. сжимаемости
(44,9*10-11 Па-1), наблюдаемый при 46°С, выражен
довольно четко. При низких давлениях и т-рах до 30 °С вязкость воды с ростом
давления падает. Высокие диэлектрич. проницаемость и диполъный момент воды
определяют ее хорошую растворяющую способность по отношению к полярным
и ионогенным в-вам. Благодаря высоким значениям С°,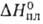 и
и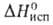 вода-важный
регулятор климатич. условий на земле, стабилизирующий т-ру на ее пов-сти.
Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает
рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость
плотности от т-ры. Поэтому не промерзают до дна крупные водоемы, что делает
возможным существование в них жизни.
вода-важный
регулятор климатич. условий на земле, стабилизирующий т-ру на ее пов-сти.
Кроме того, близость угла Н—О—Н к тетраэдрическому (109° 28') обусловливает
рыхлость структур льда и жидкой воды и, как следствие, аномальную зависимость
плотности от т-ры. Поэтому не промерзают до дна крупные водоемы, что делает
возможным существование в них жизни.
Табл. 1 - СВОЙСТВА ВОДЫ И ВОДЯНОГО ПАРА, НАХОДЯЩИХСЯ В РАВНОВЕСИИ
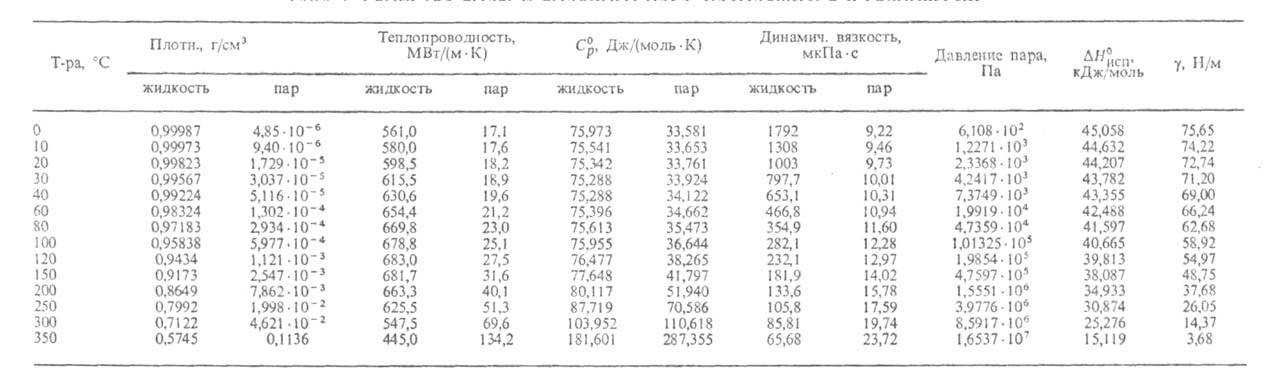
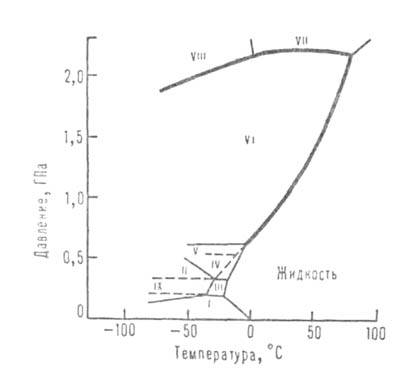
Рис. 1. Фазовая диаграмма воды.
Взаимодействие между молекулами воды. Структура конденсированных
фаз. Молекулы воды, обладая значит. ди-польным моментом, сильно взаимод.
друг с другом и полярными молекулами др. в-в. При этом атомы водорода могут
образовывать водородные связи с атомами О, N, F, Cl, S и др. В водяном
паре при невысоких т-рах и умеренных давлениях присутствует небольшое кол-во
(ок. 1% при т-ре кипения и атм. давлении) димеров воды (для них ~ 15 кДж/моль),
расстояние между атомами кислорода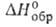 ~ 0,3 нм. В конденсиров. фазах каждая молекула воды образует четыре водородные
связи: две - как донор протонов и две - как акцептор протонов. Средняя
длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок.
0,28 нм. Угол О—Н...О стремится к 180°. Четыре водородные связи молекулы
воды направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
~ 0,3 нм. В конденсиров. фазах каждая молекула воды образует четыре водородные
связи: две - как донор протонов и две - как акцептор протонов. Средняя
длина этих связей в кристаллич. модификациях льда и кристаллогидратах ок.
0,28 нм. Угол О—Н...О стремится к 180°. Четыре водородные связи молекулы
воды направлены приблизительно к вершинам правильного тетраэдра (рис. 2).
Структура модификаций льда представляет собой трехмерную сетку. В плотных
модификациях VI-VIII, устойчивых при высоких давлениях, можно даже выделить
две такие сетки, "вставленные" одна в другую. В модификациях, существующих
при низких давлениях (льды Ih и Iс), связи Н—О—Н почти прямолинейны и направлены
к вершинам практически правильного тетраэдра. В модификациях II-VI связи
искривлены и углы между ними отличаются от тетраэдрического, что обусловливает
увеличение плотности по сравнению с плотностью обычного льда.
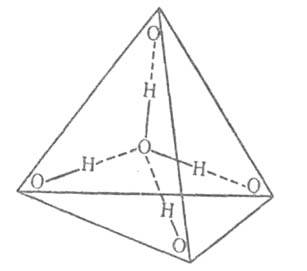
Рис. 2. Схема тетраэдрической координации молекулы воды; сплошные линии - ковалентные связи; пунктирные линии - водородные связи.
Но плотность модификаций II-VI значительно ниже той, к-рой мог бы обладать
лёд при плотной упаковке молекул. Только в модификациях VII и VIII достигается
достаточно высокая плотность упаковки: в их структуре две правильные сетки,
построенные из тетраэдров (аналогичные существующим в кубич. низкотемпературном
льде Iс, изоструктурном алмазу), вставлены одна в другую; при этом сохраняется
система прямолинейных водородных связей, а координац. число по кислороду
удваивается и достигает 8. Расположение атомов кислорода во льдах VII и
VIII подобно расположению атомов в железе
и многих др. металлах. В обычном (Ih) и кубическом (Iс) льдах, а также
во льдах HI, V-VII ориентация молекул не определена: оба ближайших к атому
О протона образуют с ним ковалентные связи, к-рые м. б. направлены к любым
двум из четырех соседних атомов кислорода в вершинах тетраэдра. Диэлектрич.
проницаемость этих модификаций высока (выше, чем у жидкой воды). Модификации
II, VIII и IX ориентационно упорядочены; их диэлектрич. проницаемость низка
(ок. 3). Лед VIII представляет собой упорядоченный по размещению протонов
вариант льда VII, а лед IX - льда III. Плотности ориентационно упорядоченных
модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных
(VII, III).
железе
и многих др. металлах. В обычном (Ih) и кубическом (Iс) льдах, а также
во льдах HI, V-VII ориентация молекул не определена: оба ближайших к атому
О протона образуют с ним ковалентные связи, к-рые м. б. направлены к любым
двум из четырех соседних атомов кислорода в вершинах тетраэдра. Диэлектрич.
проницаемость этих модификаций высока (выше, чем у жидкой воды). Модификации
II, VIII и IX ориентационно упорядочены; их диэлектрич. проницаемость низка
(ок. 3). Лед VIII представляет собой упорядоченный по размещению протонов
вариант льда VII, а лед IX - льда III. Плотности ориентационно упорядоченных
модификаций (VIII, IX) близки к плотностям соответствующих неупорядоченных
(VII, III).
Трехмерная сетка водородных связей, построенная из тетраэдров, существует и в жидкой воде во всем интервале от т-ры плавления до критической. Увеличение плотности при плавлении, как и в случае плотных модификаций льда, объясняется искривлением водородных связей и отклонением углов между ними от тетраэдрических. Искривление связей увеличивается с ростом т-ры и давления, что приводит к возрастанию плотности. С др. стороны, при нагр. средняя длина водородных связей становится больше, в результате чего плотность уменьшается. Совместное действие двух факторов объясняет наличие максимума плотности воды при 3,98 °С.
Химические свойства. Лишь незначит. доля молекул (при 25°С -
примерно 1 на 5*109) подвергается электролитич. диссоциации
по схеме: Н2О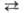 Н+
+ ОН-. Протон Н + в водной среде, взаимодействуя
с молекулами воды, образует Н3О+ , объединяющийся с
1 молекулой Н2О в H5O2+. Расстояние
О...О в таких комплексах заметно короче длины нормальной водородной связи
между нейтральными молекулами. Но поскольку протон, по-видимому, находится
не точно посредине этой укороченной связи, а ближе к одному из атомов О,
можно считать, что в воде существует гидратированный ион оксония Н3О+
. Это явление играет большую роль в хим. процессах, происходящих в разл.
системах, в т. ч. биологических. В частности, диссоциация воды - причина
гидролиза солей слабых к-т и (или) оснований. Концентрация ионов Н+
и связанная с ней концентрация ионов ОН- -важные характеристики
водных р-ров (см. Водородный показатель). Степень электролитич.
диссоциации воды заметно возрастает при повышении т-ры.
Н+
+ ОН-. Протон Н + в водной среде, взаимодействуя
с молекулами воды, образует Н3О+ , объединяющийся с
1 молекулой Н2О в H5O2+. Расстояние
О...О в таких комплексах заметно короче длины нормальной водородной связи
между нейтральными молекулами. Но поскольку протон, по-видимому, находится
не точно посредине этой укороченной связи, а ближе к одному из атомов О,
можно считать, что в воде существует гидратированный ион оксония Н3О+
. Это явление играет большую роль в хим. процессах, происходящих в разл.
системах, в т. ч. биологических. В частности, диссоциация воды - причина
гидролиза солей слабых к-т и (или) оснований. Концентрация ионов Н+
и связанная с ней концентрация ионов ОН- -важные характеристики
водных р-ров (см. Водородный показатель). Степень электролитич.
диссоциации воды заметно возрастает при повышении т-ры.
Образование воды из элементов по р-ции Н2 + 1/2O2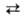 Н2O
(
Н2O
(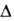 Hoобр
-242 кДж/моль для пара и -286 кДж/моль для жидкой воде) при низких т-рах
в отсутствие катализаторов происходит крайне медленно, но скорость р-ции
резко возрастает при повышении т-ры, и при 550 °С она происходит со взрывом.
При снижении давления и возрастании т-ры равновесие сдвигается влево. Степень
термич. диссоциации воды (%) при 100 кПа: 0,034 (1015°С), 0,74 (1711 °С),
8,6 (2215°С) и 11,1 (2483°С). Под действием УФ-излучения происходит фотодиссоциация
воды на ионы Н+ и ОН-. Ионизирующее излучение вызывает
радиолиз воды с образованием Н2, Н2О2 и
своб. радикалов
Hoобр
-242 кДж/моль для пара и -286 кДж/моль для жидкой воде) при низких т-рах
в отсутствие катализаторов происходит крайне медленно, но скорость р-ции
резко возрастает при повышении т-ры, и при 550 °С она происходит со взрывом.
При снижении давления и возрастании т-ры равновесие сдвигается влево. Степень
термич. диссоциации воды (%) при 100 кПа: 0,034 (1015°С), 0,74 (1711 °С),
8,6 (2215°С) и 11,1 (2483°С). Под действием УФ-излучения происходит фотодиссоциация
воды на ионы Н+ и ОН-. Ионизирующее излучение вызывает
радиолиз воды с образованием Н2, Н2О2 и
своб. радикалов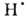
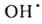
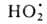 ; радиац. выход - примерно 4 распавшиеся молекулы на каждые 1,6*10-17
Дж поглощенной энергии излучения.
; радиац. выход - примерно 4 распавшиеся молекулы на каждые 1,6*10-17
Дж поглощенной энергии излучения.
Вода - реакционноспособное соединение. Она окисляется атомарным кислородом:
Н2О + О -> Н2О2. При взаимод. воды с F2
образуются HF, а также О, О2, О3, Н2О2,
F2O и др. соединения. С остальными галогенами при низких т-рах
вода реагирует с образованием смеси к-т HHal и ННаlO. При обычных условиях
с водой взаимод. до половины растворенного в ней С12 и значительно
меньшие кол-ва Вr2 и 12. При повыш. т-рах хлор и
бром разлагают воду с образованием HHal и О2. При пропускании
паров воды через раскаленный уголь она разлагается и образуется т. наз. водяной
газ: Н2О + С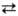 СО + Н2. При повыш. т-ре в присут. катализатора вода реагирует
с СО, СН4 и др. углеводородами, напр.: Н2О + СО
СО + Н2. При повыш. т-ре в присут. катализатора вода реагирует
с СО, СН4 и др. углеводородами, напр.: Н2О + СО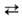 СО2 + Н2 (кат. Fe); Н2О + СН4
СО2 + Н2 (кат. Fe); Н2О + СН4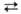 СО + ЗН2 (кат. Ni или Со). Эти р-ции используют для пром. получения
Н2. Перспективны для его произ-ва также термохим. способы разложения
воды (см. Водород, Водородная энергетика). Фосфор при нагр. с водой под
давлением в присут. катализатора окисляется в метафосфорную к-ту: 6Н2О
+ ЗР -> 2НРО3 + 5Н2. Вода взаимод. со мн. металлами
с образованием Н2 и соответствующего гидроксида. Со щелочными
и щел.-зем. металлами (кроме Mg) эта р-ция протекает уже при комнатной
т-ре. Менее активные металлы разлагают воду при повыш. т-ре, напр. Mg и Zn-выше
100°С, Fe - выше 600°С (2Fe + ЗН2О -> Fe2O3
+ 3H2). При взаимод. с воды многих оксидов образуются к-ты
или основания. Вода может служить катализатором, напр. щелочные металлы и
водород реагируют с хлором только в присут. следов воды Иногда вода - каталитич.
яд, напр. для железного катализатора при синтезе NH3.
СО + ЗН2 (кат. Ni или Со). Эти р-ции используют для пром. получения
Н2. Перспективны для его произ-ва также термохим. способы разложения
воды (см. Водород, Водородная энергетика). Фосфор при нагр. с водой под
давлением в присут. катализатора окисляется в метафосфорную к-ту: 6Н2О
+ ЗР -> 2НРО3 + 5Н2. Вода взаимод. со мн. металлами
с образованием Н2 и соответствующего гидроксида. Со щелочными
и щел.-зем. металлами (кроме Mg) эта р-ция протекает уже при комнатной
т-ре. Менее активные металлы разлагают воду при повыш. т-ре, напр. Mg и Zn-выше
100°С, Fe - выше 600°С (2Fe + ЗН2О -> Fe2O3
+ 3H2). При взаимод. с воды многих оксидов образуются к-ты
или основания. Вода может служить катализатором, напр. щелочные металлы и
водород реагируют с хлором только в присут. следов воды Иногда вода - каталитич.
яд, напр. для железного катализатора при синтезе NH3.
Способность молекул воды образовывать трехмерные сетки водородных связей позволяет ей давать с инертными газами, углеводородами, СО2, С12, (СН2)2О, СНС13 и многими др. в-вами т. наз. газовые гидраты.
Вода как растворитель. Вода хорошо растворяет мн. полярные и диссоциирующие на ионы в-ва. Обычно р-римость возрастает с увеличением т-ры, но иногда температурная зависимость имеет более сложный характер. Так, р-римость мн. сульфатов, карбонатов и фосфатов при повышении т-ры уменьшается или сначала повышается, а затем проходит через максимум. Р-римость малополярных в-в (в т. ч. газов, входящих в состав атмосферы) в воде низкая и при повышении т-ры обычно сначала снижается, а затем проходит через минимум. С ростом давления р-римость газов возрастает, проходя при высоких давлениях через максимум. Многие в-ва, растворяясь в воде, реагируют с ней. Напр., в р-рах NH3 могут присутствовать ионы NH4 (см. также Гидролиз). Между растворенными в воде ионами, атомами, молекулами, не вступающими с ней в хим. р-ции, и молекулами воды существуют не разрушающие их ион-дипольные и межмол. взаимодействия (см. Гидратация).
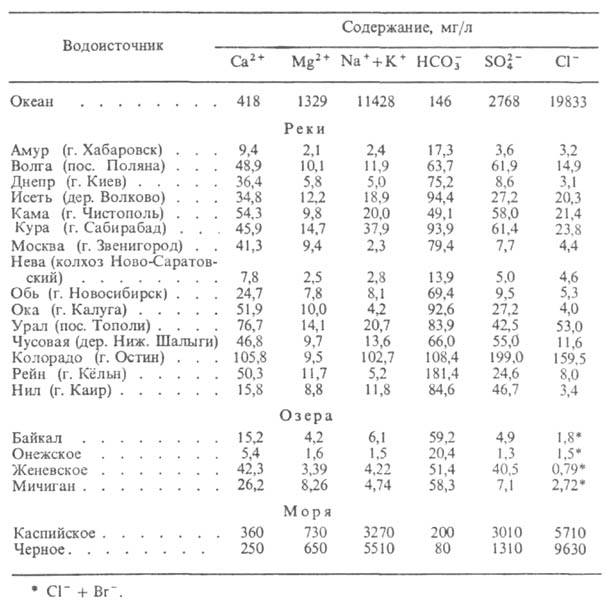
Природная вода. Представляет собой сложную многокомпонентную систему, в состав к-рой входят минер. в-ва, газы, а также коллоидные и крупнодисперсные частицы, в т. ч. микроорганизмы. По величине минерализации (г/л) различают след. природные воды: ультрапресные - до 0,2, пресные - 0,2-0,5, слабоминерализованные - 0,5-1,0, солоноватые - 1-3, соленые - 3-10, с повыш. соленостью - 10-35, переходные к рассолам - 35-50, рассолы - более 50. Макрокомпонентами природной воды обычно являются Са, Mg, Na, К, Fe (катионогенные воды), Si, С, S, C1 (анионогенные воды). К микрокомпонентам природной воды относятся редкие и рудные элементы, напр. В, Li, Rb, Cu, Zn, Bi, Be, W, U, Br, I и др.
Осн. газы, содержащиеся в прир. воде, - СО2, N2 (характерны как для поверхностных, так и для глубинных условий), СН4, СО, Н2 (более типичны для подземных водах и для воды вулканич. активных областей). Растворенные в воде компоненты находятся в равновесии, образуя комплексы разл. состава. Данные о составе нек-рых природной воды приведены в табл. 2.
Табл. 2-СОСТАВ ПРИРОДНЫХ ВОД
Питьевая вода. Общее число микроорганизмов в 1 мл питьевой воды должно
быть не выше 100, число бактерий группы кишечных палочек (коли-индекс)
- не более 3. Концентрация хим. в-в, к-рые встречаются в природной воде или добавляются
к воде при ее обработке (см. Водоподготовка), не должна превышать
(мг/л):

Содержание примесей, к-рые влияют на органолептические св-ва воды и встречаются
в природной воде или добавляются к воде при ее обработке, не должно превышать (мг/л):

Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, сухой остаток - 1000 мг/л, рН - от 6,0 до 9,0. Для питьевой воды, подаваемой без спец. обработки, по согласованию с органами санитарно-эпидемиологич. службы допускаются след. показатели: сухой остаток - до 1500 мг/л, общая жесткость - до 10 ммоль/л, содержание железа и марганца - соотв. до 1 и до 0,5 мг/л.
Техническая вода. Воду, расходуемую пром. предприятиями, принято наз. технической. Ее применяют гл. обр. в кач-ве охлаждающего агента, транспортирующей среды для сыпучих материалов (напр., гидротранспорт золы на тепловых электростанциях), р-рителя и др. В целом по всем отраслям пром-сти 70-75% от общего расхода воды применяют как хладагент по циркуляц. схеме. В этом случае вода лишь нагревается и практически не загрязняется. Главные источники загрязнения охлаждающей воды систем циркуляц. водоснабжения - вода, добавляемая в системы для восполнения неизбежных потерь, и атм. воздух, из к-poro вымываются в охладителях воды взвешенные в-ва и газы, р-римые в воде.
Осн. ионами, к-рые могут приводить к отложениям минер, солей в системах циркуляц. водоснабжения, являются анионы НСО3-, CO32-, ОН-, SOl42-, PO43-, SiO32-, а также катионы Са2+, Mg2+ , Fe2+,3+ , A13+ , Zn2+ . Наиб. часто встречающийся компонент солевых отложений - СаСО3 (см. Жесткость воды). Предотвратить отложение карбонатов можно подкислением воды H2SO4 или НС1, ее рекарбонизацией (обычно обработка топочными газами, содержащими СО2), действием полифосфатов (NaPO3)6 и Na5P3O10, орг. фосфатов и др. Для предотвращения (уменьшения) коррозии труб и теплообменного оборудования в воде добавляют ингибиторы коррозии: полифосфаты, ингибиторы на основе хромато-цинковых смесей и др. Для предупреждения обрастания оборудования бактериями воды в основном хлорируют (содержание С12 до 5 мг/л), а иногда озонируют.
Лечебные воды. В кач-ве лечебных применяют природной воде, содержащие значит. кол-во минер, солей, газы, нек-рые элементы и др. (подробнее см. Минеральные воды).
===
Исп. литература для статьи «ВОДА»: Хорн Р., Морская химия, пер. с англ., М., 1972; Эйзенберг
Д., Кауцман В., Структура и свойства воды, пер. с англ., Л., 1975; Самойлов
О. Я., Структура водных растворов электролитов и гидратация ионов, М.,
1957 Алекин О. А., Основы гидрохимии, Л., 1970; Синюков В. В., Структура
одноатомных жидкостей, воды и водных растворов электролитов, М., 1976;
Унифицированные методы исследования качества вод, ч. 1, кн. 2-3. Методы
химического анализа вод, М., 1977; Кульский Л.А., Даль В.В., Чистая вода
и перспективы ее сохранения, К., 1978; Возная Н. Ф., Химия воды и микробиология,
2 изд., М., 1979; Перельман А.И., Геохимия природных вод, М., 1982; Маленков
Г. Г., в кн.: Физическая химия. [Ежегодник], М., 1984, с. 41-76. Г.
Г. Маленков. С. В. Яковлев, В. А. Гладков.
Страница «ВОДА» подготовлена по материалам химической энциклопедии.