Структура моносахаридов
Элементарным звеном всех высших углеводов, так же как и низкомолекулярных производных этого класса, являются моносахариды. В типичных случаях их молекулы содержат прямую насыщенную цепь из пяти или шести углеродных атомов, каждый из которых несет гидроксильный заместитель, а один окислен до альдегидное или кетонной группы. Таковы, например, альдопентозы 1 (т.е. С 5 -сахара с альдегидной группой), альдогексозы 2 (т.е. С 6 -сахара с альдегидной группой), кетогексозы (C 6 -сахара с кетогруппой) и др. Кроме наиболее распространенных пентоз и гексоз, существуют еще C 3 -, C 4 -, C 7 -, C 8 - и даже C 9 -моносахариды, называемые соответственно триозами, тетрозами, пентозами, октозами и нонозами.
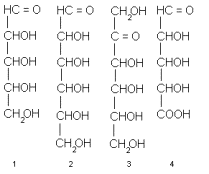
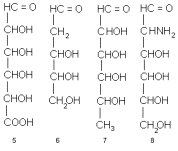
Концевое CH 2 OH-звено цепи (кстати, нумеруют углеродные атомы в моносахаридах всегда начиная с карбонильной группы или с ближайшего к ней конца цепи) может быть окислено до карбонила. При этом возникает другой распространенный подкласс моносахаридов – уроновые кислоты, например альдопентуроновые кислоты 4 или альдогексуроновые кислоты 5. В других случаях наоборот, у углеродного атома отсутствует гидроксил. Возникает так называемое дезоксизвено и соответственно дезоксисахара, например, 2-дезокси-альдопентозы (в частности, 2-дезокси-D-рибоза, комнонент ДНК) или 6-дезокси-альдогексозы 7. Одна из гидроксильных групп (а иногда и две или даже три) может быть заменена аминогруппой. Это аминосахара, как, например, 2-амино-2-дезокси-альдогексозы 8, часто, но нестрого называемые гексозаминами. Бывают, наконец, и моносахариды с разветвлением углеродного скелета а также с несколькими видами отклонений от классических структур типа 1-3 одновременно.
Не следует думать, что названные типы соединений – некие искусственные «монстры». Наоборот, все это типичные и достаточно распространенные структурные элементы более сложных природных углеводов (другое дело, что все они могут быть получены и синтетически). Более того, существуют в природе и нередко играют весьма важную роль в жизнедеятельности клетки и более сложные моносахариды, еще более отдаляющиеся по структуре и составу от классических «угле-водов». Здесь мы хотели указать на наиболее распространенные типы структурных вариаций, встречающихся в этом классе.
В каждой из рассмотренных структур имеется по нескольку ассиметричных центров и, следовательно, для каждой возможно существование 2 n стереоизомеров, где n – число ассиметрических центров. В альдогексозах (2), например, их 4. В классификационных целях из них выделяют один: тот, который максимально удален от карбонильной группы (для гексоз это С-5), и по его конфигурации (D или L) относят моносахарид соответственно к D- или L-ряду.
А как описать конфигурацию остальных центров? Для этого применяют серию тривиальных названий для всех возможных комбинаций относительных конфигураций. Так возникают такие названия, как D-глюкоза (9), D-галактоза (10), D-арабиноза (11), L-арабиноза (12), D-рибоза (13) и др.
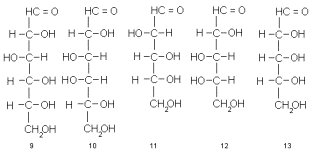
Структуры 9-13 написаны в проекции Фишера. Напомним, что по правилам фишеровской проекции, тетраэдрический углеродный атом располагают так, чтобы его четыре связи проектировались на плоскость в виде креста, причем связи, смотрящие на наблюдателя (над плоскостью бумаги), образуют горизонтальную линию, а уходящие под плоскость бумаги (от наблюдателя) – вертикальную, как это показано на примере формул 14 и 15. Чаще всего символ центрального атома опускают, заменяя его точкой пересечения прямых (формула 16). Это показано на схеме, составленной в проекции Фишера
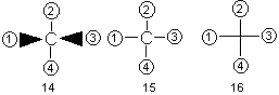
где 1-4 – заместители при центральном углеродном атоме, атом углерода в плоскости бумаги, заместители 1 и 3 – над плоскостью, заместители 2 и 4 – под плоскостью.
Итак, главные источники структурного и функционального многообразия моносахаридов лежат в различном наборе функциональных групп (карбонильные, гидроксильные, карбоксильные, аминогруппы и т.д.) и в не меньшей степени в различиях стереохимии. Последнее надо особо подчеркнуть. В обычном курсе органической химии рассматривают свойства и различия отдельных классов соединений, основанные в первую очередь на различиях бутлеровских структур, и отдельно в виде некоего экзотического приложения – вопросы стереохимии. В химии сахаров такого разделения не может быть. В принципе вся эта область есть органическая стереохимия par excellence *, и все многообразие свойств углеводов проистекает прежде всего из их стереохимических различий. Так, например, кардинальные различия свойств и биологической функции целлюлозы и одного из двух компонентов крахмала – амилозы – обусловлены различием конфигурации лишь одного ассиметричного центра элементарного звена этих стереоизомерных полисахаридов.
Целый ряд классических деструктивных методов установления строения органических веществ привел исследователей прошлого века к структурам типа 1-13 для моносахаридов.И в смысле справедливости строения углеродного скелета и положения заместителей эти структуры отражают непреложную, добытую экспериментом истину. Тем не менее они не соответствуют действительному строению моносахаридов, хотя и удобны в дидактическом плане: для описания и запоминания относительных конфигураций ассиметрических центров (чем мы в дальнейшем еще воспользуемся).
Чтобы продвинуться дальше (ближе к реальности) нам нужно вспомнить некоторые свойства карбонильных соединений. Альдегиды и кетоны (по крайней мере обычные) в присутствии кислот легко реагируют со спиртами, образуя ацетали и кетали. Как и многие другие реакции конденсации, образование ацеталей и кеталей резко ускоряется в том случае, когда реагирующие группы пространственно сближены, например расположены на подходящем расстоянии внутри одной молекулы *. Моносахарижы представлены полиоксиальдегидами или полиоксикетонами, в которых карбонильная группа может на выбор вступать в конденсацию с любым гидроксилом той же молекулы. Естественно, что такая реакция осуществляется с наиболее «удобно» расположенным гидроксилом. Вследствие ряда причин, на которых мы сейчас не будем останавливаться, оптимальное расположение карбонильной и спиртовой групп отвечает замыканию пяти- и шестичленных циклов.
Действительно, одна из спиртовых гидроксильных групп моносахарида, например D-глюкозы (9), самопроизвольно вступает в конденсацию с альдегидной группой той же молекулы с образованием ацетальной связи. При этом возникает циклическое производное, но не ацеталь, а полуацеталь, т.е. такое, в котором один из заместителей при бывшем карбонильном атоме углерода – спиртовый остаток, а другой – гидроксильная группа. Так образуются пятичленные, так называемые фуранозные циклы (17), если в реакции участвует гидроксил при С-4 или шестичленные – пиранозные циклы (18), если в реакцию вступает гидроксил при С-5.
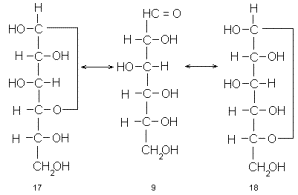
Подведем предварительные итоги. Моносахариды – это полиоксиальдегиды или полиоксикетоны с прямой (в типичных случаях) насыщенной углеродной цепью. Часть гидроксильных групп может отсутствовать или быть заменена на другие функциональные группы. Обычное состояние моносахаридов (и, как мы увидим в дальнейшем, всех их важнейших природных и синтетических производных) циклическое, включающее образование пяти- и шестичленного гетероцикла с одним атомом кислорода в цикле.
Теперь возникает технический, но немаловажный вопрос: Как их изобразить на бумаге?
Предыдущая страница |
Следующая страница
СОДЕРЖАНИЕ