Тиетан
ТИЕТАН (тиациклобутан, триметиленсульфид), мол. м. 172,12; бесцв. кристаллы со специфич. запахом; т. пл. - 73,25 °С, т. кип. 94,94 °С; 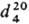 1,0288;
1,0288; 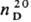 1,50887; m 5,925·20 -30 Кл·м. Моно-, ди- и полизамещенные производные тиетана-жидкости или низкоплавкие
1,50887; m 5,925·20 -30 Кл·м. Моно-, ди- и полизамещенные производные тиетана-жидкости или низкоплавкие  в-ва, хорошо раств. в орг. р-рителях. Цикл. тиетан непланарен.
в-ва, хорошо раств. в орг. р-рителях. Цикл. тиетан непланарен.
Тиетан и его производные стабильны при хранении в темноте. Перегоняются без разложения при т-ре до 150°С. На солнечном свету, в присут. кипящей НСl, разб. H2SO4 или к-т Льюиса С(С2Н5)2О·BF3, АlСl3, SnCl4 и др.] полимери-зуются.
Хлориды тяжелых металлов (напр., HgCl2), I2 и Вr2 образуют с тиетаном малостабильные мол. комплексы. Надкисло-ты, Н2О2 и КМnО4 окисляют тиетан в 1-оксид и 1,1-диоксид. Окисление HNO3 или СrО3 иногда сопровождается полимеризацией.
Для тиетана характерны р-ции с раскрытием цикла под действием электроф. и нуклеоф. агентов. Под действием Сl2 при охлаждении или SO2Cl2 при нагревании тиетана образует 3-хлор-пропилсульфенилхлорид Cl(CH2)3SCl, при взаимод. с СН3I-иодметилат I(CH2)3S+(CH3)2I-.
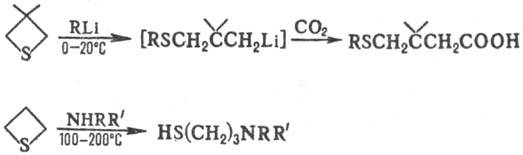
Раскрытие цикла под действием нуклеоф. агентов происходит, напр., по р-циям:
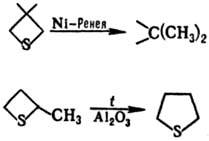
При натр. над Ni-Ренея 3-замещенные тиетана претерпевают десульфуризацию, нагревание 2-метилтиетана над Аl2О3 приводит к тиофану:
Взаимод. 2-замещенных тиетана с S идет с образованием 1,2-дитиоланов, что используется, напр., при получении биологически важной липоевой кислоты:
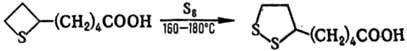
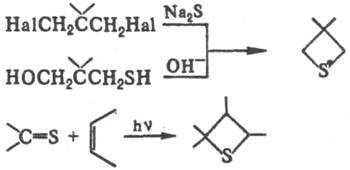
Осн. методы синтеза тиетана и его производных:
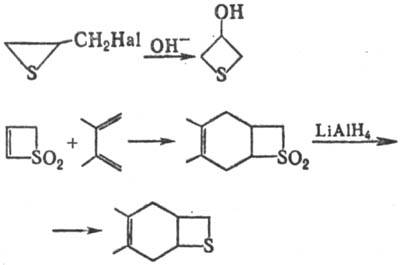
В природе встречаются 3,3-диметил- и 3-аллилтиетаны, обнаруженные в выделениях желез животных семейства куньих; применяют для отпугивания грызунов.
Тиетан и его производные малотоксичны.
Лит.: Ried W., Heinz В., "Heterrocyclic Chem.", 1984, v. 35, p. 199.
А. Ф. Коломиец.
