Металлы
МЕТАЛЛЫ (от греч. metallon-первоначально, шахта, копи), в-ва, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрич. проводимостью и теплопроводностью, отрицат. температурным коэф. электрич. проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлам относятся как собственно металлы (простые в-ва), так и их сплавы, металлические соединения, в т.ч. интерметаллиды. Иногда металлами наз. все в-ва, обладающие теми или иными металлич. св-вами, напр. т. наз. "синтетические" металлы (см. Интеркалаты), металлы органические.
Ранее характерными признаками металлов считались блеск, пластичность и ковкость - "светлое тело, которое ковать можно" (М. В. Ломоносов). Но металлич. блеском обладают и нек-рые неметаллы, напр. иод. Известны хрупкие металлы, хотя мн. из них в результате тщательной очистки получены в пластичном состоянии. В настоящее время важнейшим признаком металлов признается отрицат. температурный коэф. электрич. проводимости, т.е. понижение электрич. проводимости с ростом т-ры. Из 109 элементов в периодич. системе 86 относят к металлам. Граница между металлами и неметаллами в периодич. таблице (в ее длинном варианте) проводится по диагонали от В до At. О нек-рых элементах, напр. Ge, Sb, нет единого мнения, все же правильнее считать Ge неметаллом, т.к. он обладает полупроводниковыми св-вами, a Sb-металлом, хотя по физ. св-вам сурьма -полуметалл.
Олово существует как в металлической (b-Sn), в полупроводниковой (a-Sn) модификации. С др. стороны, у Ge, Si, P и нек-рых др. неметаллов при высоких давлениях обнаружены модификации с металлич. проводимостью. Можно предположить, что при достаточно высоких давлениях все в-ва могут приобретать металлич. св-ва. Поэтому вопрос об отнесении того или иного элемента к металлам или неметаллам следует, по-видимому, решать на основании рассмотрения не только физ. св-в простого в-ва, но и его хим. св-в. Иногда для элементов, лежащих на границе между металлами и неметаллами, применяют термин "полуметаллы", хотя этот термин в химии теперь не рекомендуется.
В металлах существует металлическая связь, характеризующаяся тем, что кристаллич. решетка образована положит. ионами, тогда как валентные электроны делокализованы по всему пространству решетки. Металлы можно представить в виде остова из положит. ионов, погруженного в "электронный газ", к-рый компенсирует силы взаимного отталкивания положит. ионов. Энергия этих делокализованных электронов-электронов проводимости - отвечает зоне проводимости. Согласно зонной теории, у металлов отсутствует запрещенная зона между валентной зоной и зоной проводимости (см. Твердое тело).
В кристаллах металлов атомы ионизированы лишь частично и часть валентных электронов остается связанной, в результате возможно появление частично ковалентных связей между соседними атомами. Прочность связи в кристаллич. структуре металлов характеризуется энтальпией атомизации, к-рая меняется от 61,4 кДж/молъ у Hg до 850 кДж/моль у W. Макс. энтальпия атомизации характерна для металлов рядов Nb-Ru и Hf-Ir. Относящиеся к ним металлы отличаются макс. т-рами плавления и высокой мех. прочностью.
Классификация металлов. Все металлы делятся на четыре группы (см. форзац): s-металлы (все s-элементы, кроме Н и Не), р-металлы (элементы гр. IIIа, кроме В, а также Sn, Рb, Sb, Bi, Ро), d-металлы и f-металлы, к-рые объединяются под назв. "переходных" (см. Переходные элементы). Металлы первых двух групп иногда наз. "простыми". Из этих групп выделяются нек-рые более узкие группы: из s-металлов- щелочные металлы и щелочноземельные элементы, из d-металлов- платиновые металлы. Группа редкоземельных элементов включает как d-, так и f-металлы (подгруппа Sc и лантаноиды).
Существует также, хотя и не общепринятая, техн. классификация металлов. В известной мере она перекликается с геохимическими классификациями элементов. Обычно выделяют след. группы: черные металлы (Fe); тяжелые цветные металлы - Сu, Pb, Zn, Ni и Sn (к этой группе примыкают т.наз. малые, или младшие, металлы - Со, Sb, Bi, Hg, Cd, нек-рые из них иногда относят к редким металлам); легкие металлы (с плотностью менее 5 г/см3)-Аl, Mg, Ca и т.д.; драгоценные металлы-Au, Ag и платиновые металлы; легирующие (или ферросплавные) металлы - Mn, Cr, W, Mo, Nb, V и др.; редкие металлы (см. Редкие элементы), разбиваемые в свою очередь на неск. групп; радиоактивные металлы-U, Th, Pu и др.
Кристаллическая структура. Большинство металлов кристаллизуется в одном из трех структурных типов (см. Металлические кристаллы), а именно-в кубич. и гексагoн. плотнейших упаковках (см. Плотная упаковка)или в объем-ноцентрированной кубич. решетке. В плотнейших упаковках каждый атом на равных расстояниях имеет 12 ближайших соседей. В объемноцентрированной кубич. решетке у каждого атома 8 равноудаленных соседей, еще 6 соседей расположены на большем (на 15%) расстоянии. Поэтому ко-ординац. число в этой структуре считают равным 14 (8 + 6). Межатомные расстояния в кристаллич. структуре металлов характеризуются металлич. радиусом (см. Атомные радиусы).
При обычных условиях щелочные металлы, а также Ва, Ra, элементы подгрупп V и Сr кристаллизуются в объемно-центрированной кубич. решетке типа a-Fe. Плотнейшая кубич. упаковка (гранецентрированная кубич. решетка) типа Си характерна для Al, Ni, металлов подгруппы Сu, платиновых металлов (кроме Ru и Os) и т. д. В гексагoн. плотнейшей упаковке типа Mg кристаллизуются Be, Са, Sr, Zn, Cd, Co, Ru, Os, элементы подгрупп Ti и Sc, мн. РЗЭ. Более сложными являются структуры разл. модификаций Мn, Ра, U, трансурановых элементов.
Многие металлы претерпевают при изменении т-ры или давления полиморфные превращения. Металлы, к-рые при низких т-рах образуют плотнейшие упаковки, напр. Са, La, Zr, часто имеют высокотемпературные модификации с объемноцентрированной кубич. структурой.
При плавлении металлы сохраняют свои электрич., тепловые и оптич. св-ва. Вблизи т-ры плавления в жидких металлах наблюдается примерно такой же ближний порядок, как и в кристаллических металлах. С повышением т-ры ближний порядок нарушается вплоть до полного разупорядочения.
Физические свойства. Физ. св-ва металлов меняются в очень широких пределах. Так, т-ра плавления изменяется от - 38,87 °С (Hg) до 3380 °С (W), плотность - от 0,531 г/см3 (Li) до 22,5 г/см3 (Os). Уд. электрич. сопротивление р при 25 °С имеет значения от 1,63 (Ag) до 140 (Мn) мкОм.см. Сопротивление движению электронов (рассеяние электронов) возникает вследствие нарушения кристаллич. решетки из-за теплового движения атомов, а также дефектов (вакансий, дислокаций, примесных атомов). Мерой его является длина своб. пробега электрона. При комнатной т-ре она равна ~ 10-6 см у металлов обычной чистоты и ~ 10-2 см у высокочистых. Температурный коэф. р (в интервале 0-100°С) меняется в пределах 1,0.10-3 (Hg)-9,0.10-3 К-1 (Be). При гелиевых т-рах (4,2 К) р практически не зависит от т-ры (rост). Его измерение используют для характеристики чистоты и совершенства кристаллов металла. Чем больше отношение r273/r4,2, тем чище металл. В монокристаллах высокой чистоты оно достигает 104-105. Нек-рые металлы при низких т-рах становятся сверхпроводниками, при этом критич. т-ра у чистых металлов от сотых долей до 9 К.
У металлов наблюдается термоэлектронная эмиссия (способность испускать электроны при высокой т-ре). Эмиссия электронов возникает также под действием электромагн. излучения в видимой и УФ областях спектра (фотоэлектронная эмиссия), внеш. электрич. поля высокой напряженности (туннельная, или автоэлектронная, эмиссия), при бомбардировке пов-сти металлов электронами (вторичная электронная эмиссия) или ионами (ионно-электронная эмиссия), при взаимод. пов-сти металла с плазмой (взрывная электронная эмиссия). Перепад т-ры вызывает в металлах появление электрич. тока (термоэдс).
Теплопроводность металлов обусловлена в осн. движением электронов, поэтому уд. коэф. теплопроводности (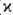 ) и электрич. проводимости (s) металлов связаны между собой соотношением
) и электрич. проводимости (s) металлов связаны между собой соотношением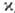 /(s•Т) = L = 2,45•10 -8 Вт•Ом/К2 (закон Видемана-Франца). Уд. коэф. теплопроводности металлов имеет значения от 425 (для Ag) до 8,41 (для Bi) Вт/(м-К).
/(s•Т) = L = 2,45•10 -8 Вт•Ом/К2 (закон Видемана-Франца). Уд. коэф. теплопроводности металлов имеет значения от 425 (для Ag) до 8,41 (для Bi) Вт/(м-К).
Температурный коэф. линейного расширения металлов в интервале 0-100°С имеет значения от 4,57.10-6 (для Os) до 10-4 K-1 (для Sr). Согласно эмпирич. правилу Грюнайзена, относит. увеличение объема металла в интервале от О К до т-ры плавления приблизительно равно 0,06. Поэтому температурный коэф. объемного расширения у тугоплавких металлов меньше, чем у легкоплавких.
У большинства металлов магн. восприимчивость по абс. величине сравнительно мала (~ 10-9) и слабо зависит от т-ры. Среди металлов есть диамагнетики, напр. Bi (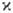 = — 1,34.10-9), и парамагнетики, причем все переходные металлы, кроме металлов I и II гр., парамагнитны. Нек-рые из них при т-рах точки Кюри переходят в магнитно-упорядоченное состояние. Металлы триады Fe, а также Gd и нек-рые др. лантаноиды - ферромагнетики, тогда как Сr, Мn, большинство лантаноидов-антиферромагнетики.
= — 1,34.10-9), и парамагнетики, причем все переходные металлы, кроме металлов I и II гр., парамагнитны. Нек-рые из них при т-рах точки Кюри переходят в магнитно-упорядоченное состояние. Металлы триады Fe, а также Gd и нек-рые др. лантаноиды - ферромагнетики, тогда как Сr, Мn, большинство лантаноидов-антиферромагнетики.
Излучения оптич. диапазона почти полностью отражаются пов-стью металлов, вследствие чего они непрозрачны и обладают характерным металлическим блеском (порошки мн. металлов матовые). Нек-рые металлы, например Аu в виде тонкой фольги, просвечивают. Отраженный от поверхности металлов плоскополяризованный свет становится эллиптически поляризованным.
Для использования металлов в качестве конструкц. материалов важнейшее значение имеет сочетание мех. св-в - пластичности и вязкости с значит. прочностью, твердостью и упругостью. Эти св-ва зависят не только от состава (чистоты металла), но и от совершенства кристаллич. решетки (наличия дефектов) и структуры, определяемых предварительной термич. и мех. обработкой образца.
Мех. св-ва реальных металлов определяются наличием дефектов, в первую очередь дислокаций, т. к. перемещение дислокаций по плоскостям кристаллич. решетки с наиб. плотной упаковкой является осн. механизмом пластич. деформации металлов. Взаимод. дислокаций с др. дефектами увеличивает сопротивление пластич. деформации. В процессе деформации число дислокаций растет, соотв. растет и сопротивление деформации (деформац. упрочнение, или наклеп). Напряженное состояние и наклеп после деформации ликвидируются при отжиге. Рост напряжений в местах "сгущения" дислокаций вызывает зарождение трещин - очагов разрушения. Важнейшая характеристика мех. св-в металлов-модуль упругости Е (модуль Юнга). Предел текучести, т. е. сопротивление пластич. деформации, 10-3-10-4 Е.
Химические свойства. Металлы обладают низкими значениями первого потенциала ионизации и сродства к электрону. Вследствие этого в хим. р-циях они выступают как доноры электронов (восстановители), а в соед. и их р-рах образуют положительно заряженные ионы (в большинстве случаев аквакатионы). Электроотрицательности атомов металлов ниже электроотрицательностей атомов неметаллов. Металлы могут входить в состав сложных анионов, напр. МnО-4, или ацидокомплексов, напр. [Fe(CN)6]4-, однако в них атомы металлов всегда являются центрами положит. заряда. Только для нек-рых металлов, находящихся на границе с неметаллами, таких, как Sn, Po, Sb и т.п., известны соед., напр. гидриды, в к-рых металлы имеют формально отрицат. степень окисления. Но во всех этих соед. хим. связь ковалентная.
Способность металлов к окислению меняется в очень широких пределах. Большинство металлов окисляется кислородом воздуха уже при обычной т-ре, однако скорость и механизм р-ции очень сильно зависят от природы металлов. В большинстве случаев при этом образуются оксиды, а у щелочных металлов, кроме Li,-пepоксиды. Устойчивость металлов на воздухе определяется св-вами образующегося оксида, в частности отношением молярных объемов Vокс/VM.. Если Vокс/VМ > 1, на металлах образуется защитная пленка, предохраняющая металлы от дальнейшего окисления. Такая пленка характерна, напр., для Al, Ti, Сr, к-рые устойчивы на воздухе, хотя и обладают высокой активностью. Металлы, для к-рых это отношение меньше 1 (напр., щелочные), на воздухе неустойчивы.
С N2 реагирует ряд металлов, напр. Li при обычной т-ре , a Mg, Zr, Hf, Ti-при нагревании. Мн. металлы активно взаимод. с Н2, галогенами, халькогенами. Все металлы, чьи стандартные электродные потенциалы отрицательнее, чем —0,413 В, окисляются водой с выделением Н2. Щелочные и щел.-зем. металлы реагируют с водой при обычных т-рах, а такие металлы, как Zn или Fe, реагируют с водяным паром при высоких т-рах. С р-рами щелочей взаимод. металлы, образующие р-римые анионные гидроксокомплексы (Be, Zn, Al, Ga, Sn).
Большинство металлов окисляется теми или иными к-тами. Металлы, имеющие отрицат. стандартные электродные потенциалы, т.е. стоящие в электрохимическом ряду напряжений до водорода, окисляются ионами Н+ и растворяются поэтому при действии неокисляющих к-т (соляная или разб. H2SO4), если не образуются нер-римые продукты. Р-ции способствует образование анионных комплексов. Азотная к-та, даже разбавленная, окисляет мн. металлы. При этом, если ионы металлов устойчивы в низших степенях окисления, образуются ка-тионные комплексы, если в высших, как в случае, напр., Re,-анионные (ReO-4 ). Нек-рые металлы реагируют с разб. HNO3 и H2SO4 с образованием катионных комплексов и пас-сивируются в конц. р-рах этих к-т. Для растворения малоактивных металлв, напр. Аu или Pt, используют смеси, содержащие окислитель и поставщик лигандов для образования р-римых комплексов, таких, как, напр., царская водка или смесь HNO3 с HF.
О взаимод, металлов со средой, ведущем к разрушению металлов, см. в ст. Коррозия металлов.
Важная характеристика металлич. элементов-их способность образовывать основные оксиды и соотв. гидроксиды. У металлов главных подгрупп периодич. системы основность оксидов и гидроксидов растет сверху вниз, в побочных подгруппах (кроме I - III) - обратная зависимость. По периодам и рядам с ростом порядкового номера элемента основность убывает. У металлов, имеющих неск. степеней окисления, как d- и f-металлы, с ростом степени окисления основность оксидов уменьшается и высшие оксиды имеют кислотный характер.
Получение металлов. Извлечение металлов из прир. сырья и др. источников - область металлургии. Можно отметить двоякий характер технологии металлов. Технология железа, тяжелых цветных металлов, а также малых металлов и большинства рассеянных элементов (халькофильных элементов) имеет "металлур-гич." характер. Это означает, что конечный продукт получают без предварит. выделения к.-л. чистого соединения, что обусловлено сравнит. легкостью восстановления до металлов как пирометаллургич. (см. Пирометаллургия), так и гидроме-таллургич. (электролиз р-ров, цементация и т.п.; см. Гидрометаллургия)путем.
Иной характер имеет технология легких, а также редких металлы (литофильных элементов). Это связано с трудностями их получения в своб. состоянии. Для этих металлов технология разбивается четко на два этапа - получение чистого соед., напр. Аl2О3, и получение металла из этого соединения. Сами металлы в произ-ве их соед. обычно не используют. Поэтому можно сказать, что технология этих металлов имеет более "химический" характер.
Способность металлов к взаимному растворению с образованием при кристаллизации твердых растворов и интерметал-лидов, разнообразным фазовым превращениям дает возможность получения большого числа сплавов, отличающихся разл. структурой и самыми разнообразными сочетаниями св-в. В совр. технике применяют св. 30 000 разл. сплавов - легкоплавких и тугоплавких, очень твердых и пластичных, с большой и малой электрич. проводимостью, ферромагнитных и др. В сплавах ныне используют практически все известные металлы (кроме искусственно полученных трансплутониевых элементов). Мера использования в значит. степени определяется доступностью металла-содержанием в земной коре, а также степенью концентрирования в месторождениях и трудностью получения. Использование сплавов (бронзовый век) было одним из важнейших этапов становления человеческой цивилизации. И в настоящее время сплавы-важнейшие конструкционные материалы. В последние годы наблюдается тенденция нек-рого снижения роли железа и увеличение использования легких металлов (Al, Mg) и наиб. доступных редких металлов (Ti, Nb, Zr).
Исп. литература для статьи «МЕТАЛЛЫ»: Пирсон У., Кристаллохимия и физика металлов и сплавов, пер. с англ., ч. 1-2, М., 1977; Уманский Я. С., Скаков Ю.А., Физика металлов. Атомное строение металлов и сплавов, М., 1978; Бернштейн М. Л., Зай-мовский В. А., Механические свойства металлов, 2 изд., М., 1979; Лившиц Б. Г., Крапошин В. С., Липецкий Я. Л., Физические свойства металлов и сплавов, 2 изд., М., 1980; Баррет Ч. С., Массальский Т. Б., Структура металлов, пер. с англ., ч. 1-2, М., 1984; Гуляев А. П., Металловедение, 6 изд., М., 1986; Зайцев Б. Е., Общие физические и химические свойства металлов, М., 1987; Пекшева Н. П., Химия металлов, Красноярск, 1987; Абрикосов А. А., Основы теории металлов, М., 1987; Бобылев А. В., Механические и технологические свойства металлов, 2 изд., М., 1987. П. И. Федоров.
