Газы
ГАЗЫ, в-ва в агрегатном состоянии, характеризующемся слабым взаимод. составляющих в-во частиц (по сравнению с их средней кинетич. энергией), в результате чего газы заполняют весь предоставленный им объем. Газы, как и нормальные (обычные) жидкости, макроскопически однородны и изотропны при отсутствии внеш. воздействий, в отличие от анизотропных состояний в-ва - твердого кристаллического и жидких кристаллов. Строго различать жидкое и газообразное состояния в-ва на фазовой диаграмме можно лишь при т-ре ниже критической Гкр (см. рис.), т.к. выше Ткр газ нельзя превратить в жидкость повышением давления. Ниже Ткр возможно фазовое равновесие жидкость — пар, причем газообразному состоянию отвечает фаза с меньшей плотностью (газ, находящийся в термодинамич. равновесии с жидкой или твердой фазой того же в-ва, обычно наз. паром). В критич. точке различие между жидкостью и паром исчезает, поэтому возможен непрерывный (без фазового превращения) переход из газообразного состояния в жидкое. При этом все св-ва в-ва меняются постепенно (наиб, быстро вблизи критич. точки). В тройной точке Т^ сосуществуют газ, жидкость и твердое тело (кристалл), причем плотность газа вблизи тройной точки обычно на три порядка меньше плотности жидкости или кристалла. Кривую сосуществования жидкости и газа называют кривой парообразования, твердого тела и газа - кривой сублимации (возгонки). 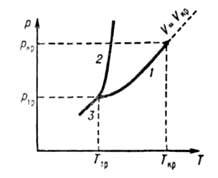
Диаграмма состояния однокомпонентной системы в координатах давление(P) температура(Т). Линии 1, 2 и 3-кривые парообразования, плавления и возгонки соотв.; 7"кр и ркр-координаты критич. точки; Ттр и ртр-координаты тройной точки; И,—-Критич. объем.
В нормальных условиях (при 0°С и атм. давлении) в газообразном состоянии находятся элементы гелиевой группы (Не, Ne и т. д.), а также ряд элементов, образующих молекулярные газы: О2, N2, Н2, Г2 и С12. Атм. воздух состоит из N2 и О2 (соотв. 75,5 и 23,1% по массе), благородных газов, N2O, CO2 и паров Н2О (остальные 1,4%). В природе газы образуются как продукты жизнедеятельности бактерий, при превращениях орг. в-в, восстановлении минер. солей и др. В недрах Земли газы, в основном СН4 и др. легкие углеводороды, как правило, сопутствуют нефтям; встречаются газовые месторождения, содержащие до 70% неуглеводородных компонентов (H2S, CO2 и" др.).
При низких давлениях газы смешиваются друг с другом в любых соотношениях. При высоких давлениях и т-рах выше Ткр взаимная р-римость газов может быть ограниченной и возможно равновесное сосуществование двух газовых фаз; такие системы рассматривают как расслаивающиеся газовые р-ры (см. Критическое состояние). Р-римость газов в жидкостях и твердых телах может достигать больших значений (см. табл. 1).
Табл. 1.-РАСТВОРИМОСТЬ ГАЗОВ В ЖИДКОСТЯХ ПРИ 298 К И 10s Па (в мольных долях) 
Теория газообразного состояния. Важнейшая теоретич. модель газообразного состояния - идеальный газ, для к-рого энергия взаимод. между молекулами пренебрежимо мала по сравнению с кинетич. энергией их хаотич. (теплового) движения. Ур-ние состояния для п молей идеального газа, занимающего объем V при т-ре Т и давлении р, имеет вид: pV = nRT, где R = 8,31 ДжДмоль-К)-газовая постоянная (см. Клапейрона - Менделеева уравнение). Внутр. энергия 1 моля одноатомного идеального газа ? = 3/2/?Т ДлЯ идеального газа строго выполняются Бойля-Мариотта закон и Гей-Люссака законы, для реальных газов эти законы выполняются приближенно-тем лучше, чем дальше р и Т от критич. значений.
Статистич. физика позволяет вычислить макроскопич. св-ва идеального газа, рассматривая его как систему из N квазинезависимых молекул и определяя вероятность раз л. состояний отдельной молекулы. В идеальном газе для каждой из молекул все окружающие частицы представляют термостат, с к-рым она обменивается энергией. В соответствии с канонич. распределением Гиббса среднее число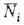 молекул в 1-том состоянии с энергией Е, равно:
молекул в 1-том состоянии с энергией Е, равно: 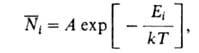
где k- постоянная Больцмана; Л-коэф., зависящий от Т. Применение данной ф-лы в случае, когда движение молекул идеального газа подчиняется законам классич. механики, позволяет установить распределение молекул по скоростям, а также их пространств. распределение в поле внеш. сил. В соответствии с распределением Максвелла среднее число dN молекул с массой ш, компоненты скоростей к-рых лежат в интервалах от vx до vx + dvx, от vy до vy + dvy и от v. до vz + dvz, равно: 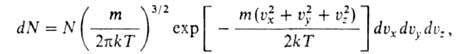
где N- общее число молекул. В любом реальном газе распределение по скоростям центров инерции молекул представляет собой распределение Максвелла. При наличии внеш. силового поля, в к-ром потенциальная энергия молекулы идеального газа зависит от координат ее центра инерции, концентрация молекул устанавливается распределением Больцмана: 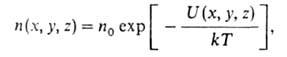
где п0- концентрация молекул в отсутствие поля; U(x, у, z)- потенциальная энергия молекулы во внеш. поле. В частности, в однородном поле тяжести, направленном вдоль оси z, U = mgz, где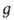 -ускорение своб. падения, и распределение плотности газа определяется т. наз. барометрической формулой:
-ускорение своб. падения, и распределение плотности газа определяется т. наз. барометрической формулой: 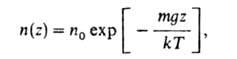
где и0 - плотность газа в точке z = 0.
При низких т-рах классич. статистика неприменима к идеальному газу и заменяется квантовой статистикой Бо-зе-Эйнштейна или Ферми-Дирака для частиц с целым или полуцелым спином соответственно. Т-ра, ниже к-рой отчетливо проявляются квантовые св-ва идеального газа, тем выше, чем меньше масса частиц и чем больше плотность числа частиц. Для обычных газов соответствующая т-ра очень низка; квантовые эффекты практически существенны лишь для Не, Н2 и в нек-рой степени для Ne. Квантовую природу системы, проявляющуюся в дискретности энергетич. спектра, необходимо учитывать при описании внутр. состояний молекул (электронных, колебательных, а при низких т-pax-и вращательных). Энергетич. спектр молекул газа, соответствующий их постулат, движению, можно считать квазинепрерывным, т.к. расстояния между соседними уровнями энергии малы.
Применение законов классич. статистики с учетом квантовых закономерностей позволяет рассчитать по молекулярным данным термодинамич. функции газа (энтропию, внутр. энергию, энергии Гельмгольца и Гиббса), константы хим. равновесия газофазных р-ций, теплоемкость и кинетич. характеристики, знание к-рых требуется при проектировании мн. технол. процессов. Так, теплоемкость идеального газа может быть рассчитана в классич. теории, если известно число i степеней свободы молекулы. Вклад каждой из вра-щат. и постулат, степеней свободы молекулы в молярную теплоемкость Су равен R/2, а каждой из колебат. степеней свободы-JR (т. наз. закон равнораспределения). Частица одноатомного газа обладает тремя постулат, степенями свободы, соотв. его теплоемкость составляет ЗЯ/2, что хорошо совпадает с эксперим. данными. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебат. степенями свободы, и, согласно закону равнораспределения, Су = 1R/2, однако это значение не совпадает с опытными данными даже при обычных т-рах. Наблюдаемое расхождение, а также температурная зависимость теплоемкости газа объясняются квантовой теорией (подробнее см. в ст. Теплоемкость).
Кинетич. св-ва газов - теплопроводность, взаимная диффузия (для газовых смесей), вязкость-определяются столкновениями молекул. В простейшем случае явления переноса рассматриваются для разреженного газа, молекулы к-рого считаются упругими шарами, взаимодействующими лишь в момент соударения. В первом приближении все коэф. переноса выражаются через среднюю длину своб. пробега молекулы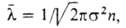 где
где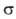 -диаметр молекулы. Так,
-диаметр молекулы. Так,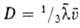 , где
, где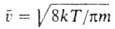 -средняя скорость теплового движения молекул. Более строгая теория учитывает взаимод. молекул на расстоянии, что приводит к появлению в выражениях для коэф. переноса т. наз. интегралов столкновений, к-рые м. б. рассчитаны, если известен вид потенциала межмолекулярных взаимодействий.
-средняя скорость теплового движения молекул. Более строгая теория учитывает взаимод. молекул на расстоянии, что приводит к появлению в выражениях для коэф. переноса т. наз. интегралов столкновений, к-рые м. б. рассчитаны, если известен вид потенциала межмолекулярных взаимодействий.
Свойства реальных газов. Неидеальность газов в молекуляр-но-кинетич. теории рассматривается как результат взаимод. молекул. В первом приближении ограничиваются рассмотрением парных взаимодействий, во втором-тройных и т.д. Такой подход приводит к вириалъному уравнению состояния, коэф. к-рого м. б. теоретически рассчитаны, если известен потенциал межмол. взаимодействий. Наиб. полезно вириальное ур-ние при рассмотрении св-в газов малой и умеренной плотности. Предложено много эмпирич. и по-луэмпирич. ур-ний, связывающих р, V и Т, к-рые либо исходят из нек-рой простой модели взаимодействий (напр., Ван-дер-Ваалъса уравнение), либо выражают чисто эмпирич. зависимость, справедливую для определенного класса в-в (см. Уравнения состояния).
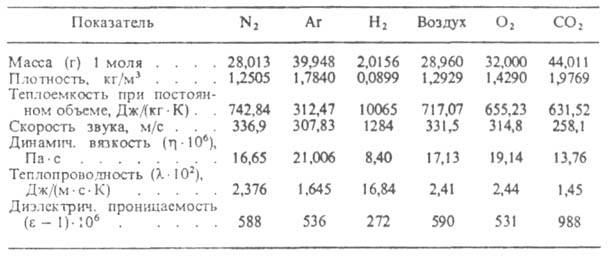
Наличие межмол. взаимодействий оказывает влияние на все св-ва реальных газов, в т.ч. приводит и к тому, что их внутр. энергия зависит от плотности. С этим св-вом связан эффект Джоуля-Томпсона: изменение т-ры газа при его адиабатич. расширении, напр. при протекании с малой постоянной скоростью через пористую перегородку (этот процесс наз. дросселированием). Учет межмол. взаимодействий и внутр. строения молекул необходим при решении мн. теоретич. задач физ.химии. Молекул, к-рые можно было бы принимать как упругие шары, практически не бывает, и при расчете св-в реальных газов применяют др. молекулярные модели. Из них Наиб. употребительны простые модели гармонич. осциллятора и жесткого ротатора. Физ. св-ва нек-рых газов приведены в табл. 2 [по данным Автоматизированной информац. системы достоверных данных о теплофиз. св-вах газов и жидкостей (АИСТ)].
Литература
Гиршфельдер Дж., КертиссЧ., Берд Р., Молекулярная теория газов и жидкостей, пер. с англ., М., 1961; Рид Р., ПраусницДж., Шервуд Т., Свойства газов и жидкостей, пер. с англ., Л., 1982; Смирнова Н. А., Методы статистической термодинамики в физической химии, 2 изд., М, 1982. М. А. Анисимов.
Табл. 2.-ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ ГАЗОВ ПРИ НОРМАЛЬНЫХ УСЛОВИЯХ (Г= 273,15 К, р = 1,01 * 105 Па)