Равновесие
А. Реакции переноса групп
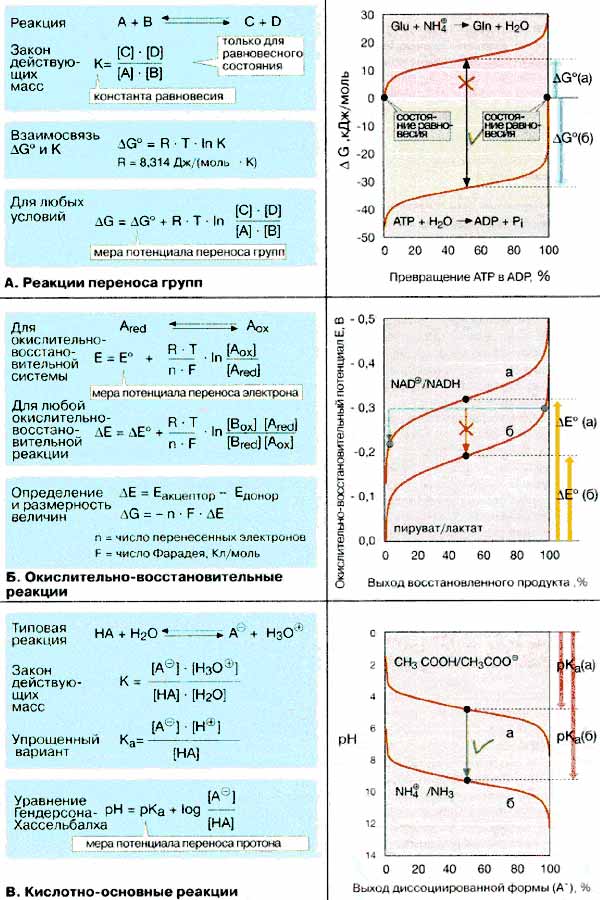
Каждая химическая реакции по истечении некоторого времени достигает состояния равновесия, при котором прямая и обратная реакции идут с равными скоростями. Соотношение концентраций исходных веществ (А, В) и конечных продуктов (С, D) в равновесном состоянии описываются законом действующих масс. Константа равновесия К непосредственно связана с изменением свободной энергии реакции в стандартных условиях ΔG° (ΔG° = -RT ln К) Уравнение действительно для любых концентраций веществ. Если ΔG < 0, реакция протекает спонтанно до тех пор. пока не будет достигнуто равновесие (т. е. до ΔG° = 0). При ΔG > 0 реакция не может протекать спонтанно (эндергонический процесс, см. с. 22). В биохимии ΔG обычно относят к pH 7 и обозначают как ΔG0 ' или ΔG '.
В качестве примера на схеме приводятся две реакции переноса групп. Перенос фосфатных групп от аденозинтрифосфата [АТФ (АТР)] к воде — высокоэкзергонический процесс [реакция а]. Равновесие наступает лишь при гидролизе более 99,9% исходного АТФ. АТФ и родственные соединения являются высокоэффективными переносчиками фосфатных групп. Количественно это свойство выражается величинами свободной энергии реакции гидролиза ΔG°.
Напротив, эндергонический процесс — перенос аммиака (NH3) на глутамат [GIu, реакция б] — достигает равновесия настолько быстро, что за это время успевает образоваться минимальное количество глутамина. Поэтому синтез глутамина из названных предшественников возможен лишь при сопряжении с экзергонической реакцией (см. с. 22, 126).
Б. Окислительно-восстановительные реакции
Реакции переноса электронов также протекают в соответствии с законом действующих масс. Для отдельной окислительно - восстановительной системы (редокс-системы) справедливо уравнение Нернста. Потенциал переноса электронов такой системы (т.е. склонность системы отдавать и принимать электроны) определяется ее окислительно-восстановительным потенциалом в стандартных условиях (стандартным восстановительным потенциалом E° и соответственно Е°' при pH 7). При описании реакций между двумя редокс-системaми вместо ΔG обычно используют разность потенциалов двух систем (ΔΕ). ΔΕ и ΔG связаны простым соотношением, но имеют противоположные знаки. Окислительно-восстановительная реакция протекает спонтанно, если ΔΕ > 0.
В правой части схемы представлена зависимость потенциала E от соотношения реагентов (приведена доля восстановленной формы в процентах) для двух важных в биохимическом отношении систем (пируват/лактат и НАД+/HАДH (NAD+/NADH) см. рис. 103). В стандартных условиях (обе системы восстановлены на 50%) перенос электрона с лактата на НАД+ невозможен, поскольку ΔΕ — величина отрицательная (-0,13 В, красная стрелка). Но перенос имеет место в том случае, если система пируват/лактат восстановлена на 98%, а система НАД+/HАДH окислена на 98% (зеленая стрелка, ΔΕ = +0,08 B).
В. Кислотно-основные реакции
В реакциях переноса протона всегда принимает участие пара сопряженных кислот и оснований. Степень диссоциации кислотно-основной пары зависит от концентрации H+. Чаще всего приводится не собственно концентрация протонов, а ее отрицательный логарифм, величина pH. Взаимосвязь между pH и константой диссоциации описывается уравнением Гендерсона-Хассельбалха. В качестве меры химического потенциала переноса протона кислотно-основной пары служит величина рКа — отрицательный логарифм константы диссоциации кислоты Ка. Чем сильнее кислота, тем меньше ее рКа. Кислоты с небольшими pKа могут протонировать основания с высокими рКа(зеленая стрелка).


