Нeрнста уравнение
НEРНСТА УРАВНЕНИЕ, описывает зависимость равновесного потенциала электрода от термодинамич. активности (концентрации) потенциал-определяющих компонентов р-ра электролита. Пусть на границе электрод-раствор в равновесных условиях протекает процесс
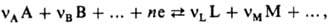
где А, В, ..., L, М, ...-реагенты, vA, vB, ..., vL, vM, ...-их стехиометрич. коэф., "-число электронов, участвующих в р-ции. Для гальвани-потенциала электрода (см. Межфазные скачки потенциала)Нернста уравнение записывается в виде:
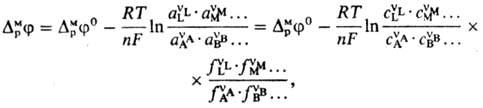
где DMpj0-постоянная, R-газовая постоянная, Т-т-ра, F-постоянная Фарадея, сi, ai, fi-соотв. концентрации, активности и коэф. активности реагентов. Поскольку абс. значения гальвани-потенциала невозможно определить, часто приводится аналогичное выражение для потенциала электрода относительно определенного электрода сравнения:
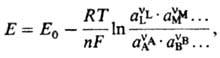
где Е0-эмпирич. постоянная, зависящая от выбора электрода сравнения. Использование концентраций сi вместо активностей аi в Нернста уравнении возможно лишь для разб. р-ров и при избытке индифферентного электролита.
Нернста уравнение впервые было получено В. Нернстом в 1888 для частного случая системы металл М-ион Mz+ (z-зарядовое число ионов металла в р-ре) в виде:
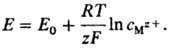
Лит.: Корыта И., Дворжак И., Богачкова В., Электрохимия, пер. с чеш., М., 1977; Дамаскин Б. Б., Петрий О.А., Основы теоретической электрохимии, М., 1978. Б. И. Подловченко.
