Водородный электрод
Водородный электрод, платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал водородного электрода возникает за счёт обратимо протекающей реакции
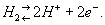
Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста:
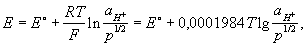
где Т — абсолютная температура (К), аН+ — активная концентрация ионов водорода (г-ион/л), р — давление водорода [кгс/см2 (атм)], Е° — нормальный (или стандартный) потенциал водородного электрода при р = 1 кгс/см2 (1 атм) и aH+ = 1. При любой заданной температуре Е° условно принято считать равным нулю. От потенциала стандартного водородного электрода отсчитывают потенциалы всех других электродов (так называемая водородная шкала потенциалов). При работе с водородным электродом необходима тщательная очистка водорода от примесей. Особенно опасны соединения серы и мышьяка, а также кислород, реагирующий с водородом на поверхности платины с образованием воды, что приводит к нарушению равновесия
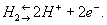
Водородный электрод применяют как электрод сравнения.
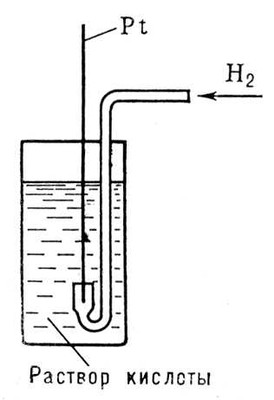
Рисунок к ст. Водородный электрод.

Дополнения к описанию водородного электрода:
Конструкция и принцип работы:
Калибровка и стандартизация:
Ограничения применения:
Значимость: