Сера
СЕРА (Sulfur) S, хим. элемент VI гр. периодич. системы, ат. н. 16, ат. м. 32,066; относится к халькогенам. Природная сера состоит из четырех изотопов: 32S (95,084%), 33S(0,74%), 34S(4,16%), 36S(0,016%). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 0,52·10-28 м2. Конфигурация внеш. электронной оболочки атома 3s2 3р4; наиб. характерные степени окисления — 2, +4, +6; энергии ионизации при последоват. переходе от S0 к S6+ равны соотв. 10,3601, 23,35, 34,8, 47,29, 72,5, 88,0 эВ; сродство к электрону 2,0772 эВ; электроотрицательность по Полингу 2,58; атомный радиус 0,104 нм. ионные радиусы (в скобках даны координац. числа), нм: S2- 0,170 (6), S4+ 0,051 (6), S6+ 0,026 (4).
Сера-довольно распространенный элемент, среднее содержание в земной коре 0,05 % по массе, в воде морей и океанов 0,09%. Известны многочисл. минералы серы: самородная сера (главные месторождения в США, СНГ, Мексике, Италии, Японии); сульфидные минералы-пирит FeS2, антимонит Sb2S3, галенит PbS, киноварь HgS, сфалерит и вюрцит ZnS, ковеллин CuS, халькозин Cu2S, аргентит Ag2S, висмутин Bi2S3, халькопирит CuFeS2 и др.; сульфаты -барит BaSO4, ангидрит CaSO4, гипс CaSO4·2H2O, мирабилит Na2SO4 x x 10Н2 О и др. Кроме того, сера присутствует в виде соед. в углях, сланцах, нефти, прир. газах. Сера-биогенный элемент, входит в состав белков, витаминов.
Свойства. До 95,39°С стабильна a-S-при комнатной т-ре лимонно-желтые кристаллы (табл. 1); выше 95,39° С стабильна b-S-при комнатной т-ре бледно-желтые кристаллы, DН перехода a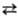 b 0,400 кДж/моль. Кристаллич. структура a- и b-S построена из неплоских восьмичленных циклич. молекул S8 в виде короны. a- и b-S различаются взаимной ориентацией молекул S8 в кристаллич. решетке.
b 0,400 кДж/моль. Кристаллич. структура a- и b-S построена из неплоских восьмичленных циклич. молекул S8 в виде короны. a- и b-S различаются взаимной ориентацией молекул S8 в кристаллич. решетке.
Сера легко образует циклич. молекулы с разным числом атомов п. Для циклич. молекул найдены след. значения энергии связи (Е, кДж/моль) S—S:
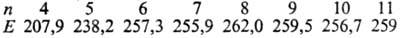
Цикл S8 предпочтителен, др. циклы менее устойчивы, особенно S5 и S4. Получены метастабильные модификации от оранжевого (S6) до лимонно-желтого (S20) цвета.
При быстром охлаждении бензольного р-ра серы получена метастабильная, т. наз. перламутровая, сера, содержащая в структуре циклы S8, отличающиеся по конфигурции от молекул S8 a- и b-S. Известна ромбоэдрическая сера, образованная молекулами S6. Аморфную [плотн. 1,92 г/см3, 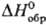 0,397 кДж/моль,
0,397 кДж/моль, 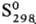 33,18 Дж/(моль·К)] и пластическую (резиноподобную) серу получают при резком охлаждении расплавленной серы; напр., пластич. форму - выливанием расплава серы с т-рой 190°С в холодную воду. Эти формы состоят из длинных нерегулярно расположенных зигзагообразных цепей Sm. Аморфная и все др. формы серы превращ. в a-S при длит. выдерживании их при 20-95°C. При 96-110°С аморфная и все др. формы серы, в т.ч. а, переходят в b-S. При давлении 1,6-2,7 ГПа сера претерпевает новые полиморфные превращения. Ур-ния температурной зависимости давления пара: над a-S lgp(Па) = 16,557--5166/Т (20-80 °С), над b-S lgp(Па) = 16,257-5082/Т (96-116°С). Твердые и жидкая формы серы диамагнитны, магн. восприимчивость a-S — 1,56·10-7, b-S — 1,4·10-7. Парамагнитна молекула S2. a-S относят либо к высокоомным полупроводникам, либо к диэлектрикам, ширина запрещенной зоны 2,6 эВ, r 1,9·1017 Ом·см; температурный коэф. линейного расширения 4,567·10-5°С-1 (0-13°С), 2,67 x x 10-6°С-1 (78-97°С), 10,32°С-1 (98-110°С); теплопроводность 1,994 Вт/(см·К).
33,18 Дж/(моль·К)] и пластическую (резиноподобную) серу получают при резком охлаждении расплавленной серы; напр., пластич. форму - выливанием расплава серы с т-рой 190°С в холодную воду. Эти формы состоят из длинных нерегулярно расположенных зигзагообразных цепей Sm. Аморфная и все др. формы серы превращ. в a-S при длит. выдерживании их при 20-95°C. При 96-110°С аморфная и все др. формы серы, в т.ч. а, переходят в b-S. При давлении 1,6-2,7 ГПа сера претерпевает новые полиморфные превращения. Ур-ния температурной зависимости давления пара: над a-S lgp(Па) = 16,557--5166/Т (20-80 °С), над b-S lgp(Па) = 16,257-5082/Т (96-116°С). Твердые и жидкая формы серы диамагнитны, магн. восприимчивость a-S — 1,56·10-7, b-S — 1,4·10-7. Парамагнитна молекула S2. a-S относят либо к высокоомным полупроводникам, либо к диэлектрикам, ширина запрещенной зоны 2,6 эВ, r 1,9·1017 Ом·см; температурный коэф. линейного расширения 4,567·10-5°С-1 (0-13°С), 2,67 x x 10-6°С-1 (78-97°С), 10,32°С-1 (98-110°С); теплопроводность 1,994 Вт/(см·К).
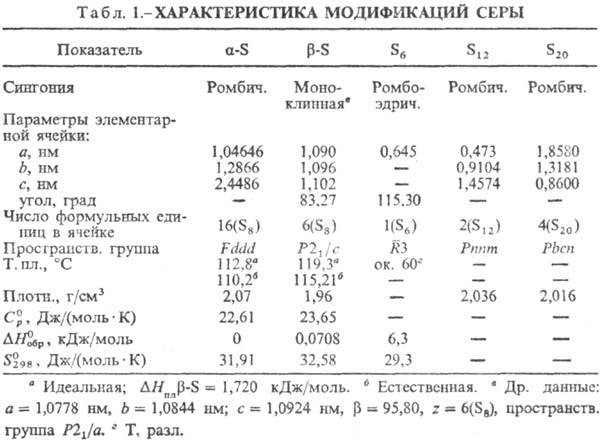
Мн. модификации серы характеризуются "идеальной" т-рой плавления-для серы, расплав к-рой перед кристаллизацией содержал практически один сорт молекул (в осн. S8), и "естественной" т-рой плавления-для серы, расплав к-рой перед кристаллизацией длительно выдерживался и в результате содержал смесь разл. молекул (такие расплавы обозначают Sl, Sp, Sm). Напр., для перламутровой серы идеальная т. пл. 106,8 °С, естественная т. пл. 103,5 °C. Sl отделяют от Sp и Sm обработкой CS2, в к-ром. Sl раств., а Sp (содержит полимерные цепи из S8) и Sm (содержит полимерные цепи из одноатомной S)-нет.
Расплав серы вблизи т-ры плавления-подвижная желтая жидкость, содержит циклич. молекулы S8 и, в незначит. степени, Sn, где n = 6, 7, 9, 10; h 0,011 Па·с (120 °С), g 60,83 мН/м (120°С). При нагр. выше 120°С циклич. молекулы превращ. в полимерные цепи Sm, процесс протекает заметно при ~ 160 °С, этой же т-ре отвечает максимум (159,6 °С) на кривой зависимости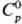 от т-ры; h резко увеличивается от 6,5·10-3 Па·с (155°С) до 93,3 Па·с (187°С); g 56,67 мН/м (150°С). При 187°С расплав темно-коричневого цвета, практически нетекуч. При нагр. выше 187°С цепи разрываются, укорачиваются, жидкость вновь становится подвижной, напр. h при 355°С 0,432 Па·с, при 444°С 0,083 Па·с; ур-ния температурной зависимости: плотности d = 1,9035 — - 0,000832/ (120 < t < 155 °С), d = 1,8818 - 0,0006235t (157 <
от т-ры; h резко увеличивается от 6,5·10-3 Па·с (155°С) до 93,3 Па·с (187°С); g 56,67 мН/м (150°С). При 187°С расплав темно-коричневого цвета, практически нетекуч. При нагр. выше 187°С цепи разрываются, укорачиваются, жидкость вновь становится подвижной, напр. h при 355°С 0,432 Па·с, при 444°С 0,083 Па·с; ур-ния температурной зависимости: плотности d = 1,9035 — - 0,000832/ (120 < t < 155 °С), d = 1,8818 - 0,0006235t (157 <
Т. кип. серы 444,6 °С, DHисп 9,2 кДж/моль. Пар содержит молекулы Sn, где n = 2-12 (табл. 2). при 150°С в паре преобладают молекулы S8, в меньшей степени присутствуют S6 и S7, при 444,6 °C-S8, S6, S7, незначительно S2, при 600°C-S8, S6, S7 в равных кол-вах, меньше S2, при 700°С-примерно в равных кол-вах S2, S6, S8, S7, незначительно S3, выше 730 °C преобладают молекулы S2, выше 1500°С-одноатомная S.
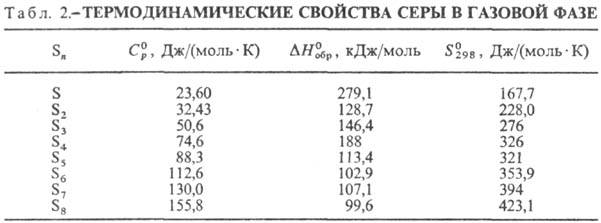
Сера не раств. в воде, плохо раств. в этаноле, гептане, гексане, лучше-в толуоле, бензоле (табл. 3). Лучшие р-рители для серы-жидкий NH3 (под давлением), CS2, S2C12.
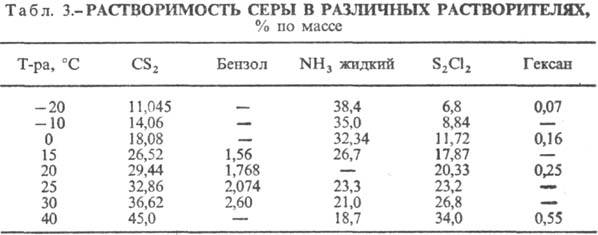
Последние два используют в пром-сти как р-рители серы, S2Сl2-при вулканизации каучука; 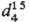 р-ров серы в CS2 (в скобках даны % по массе S): 1,2901 (4), 1,3096 (8), 1,3297 (12), 1,3709 (20). Сера, содержащая полимерные цепи (аморфная, пластин.), не раств. в CS2. В расплавленной сере заметно раств. H2S, SO2, As2S3, P2S5 и др.
р-ров серы в CS2 (в скобках даны % по массе S): 1,2901 (4), 1,3096 (8), 1,3297 (12), 1,3709 (20). Сера, содержащая полимерные цепи (аморфная, пластин.), не раств. в CS2. В расплавленной сере заметно раств. H2S, SO2, As2S3, P2S5 и др.
Конц. Н2 SO4 окисляет расплавленную сера при ~120°С до SO2, конц. HNO3, смеси соляной к-ты с окислителями (КС1О3, НNО3)-до H2SO4. Разб. HNO3, соляная к-та без добавок окислителей, Н2 SO4 на холоду с серой не реагируют. Мелкодисперсная сера взаимод. при нагр. с р-рами щелочей, давая сульфиты и сульфиды, а затем полисульфиды и тио-сульфаты. Сера непосредственно соединяется почти со всеми элементами, кроме инертных газов, иода, азота, Pt, Аu. При 280°С сера горит в О2, а при 360°С в воздухе, образуя в осн. серы диоксид, а также серы триоксид. Смесь паров серы и О2 взрывается.
Оксиды серы, кроме SO2 и SО3, неустойчивы. S2О-газ; 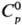 44,3 Дж/(моль·К);
44,3 Дж/(моль·К); 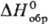 -108,9 кДж/моль;
-108,9 кДж/моль;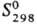 267,3 Дж/(моль·К); образуется при пропускании SO2 в тлеющем разряде. Кристаллич. S8O образуется при взаимод. Н28„ с SOC12, жидкий SО4 (т. пл. 3°С, с разл.)-из SO2 и О2 в тлеющем разряде при —190 °C Жидкий S2O7 (т. пл. 0°С,
267,3 Дж/(моль·К); образуется при пропускании SO2 в тлеющем разряде. Кристаллич. S8O образуется при взаимод. Н28„ с SOC12, жидкий SО4 (т. пл. 3°С, с разл.)-из SO2 и О2 в тлеющем разряде при —190 °C Жидкий S2O7 (т. пл. 0°С, 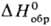 — 811,7 кДж/моль) образуется при окислении SO2 озоном или при разложении SO4. Соед. SO4 и S2 O7 содержат пероксидную группировку —О—О—, формально им соответствуют пероксомоносерная к-та (к-та Каро) H2SO5 (т. пл. 47°С, с разл.) и пероксодисерная к-та Н2S2О8 (т. пл. 65 °С, с разл.), к-рые образуются при электролизе H2SO4 или гидросульфатов при произ-ве Н2О2. Известны также S6O и S7O2.
— 811,7 кДж/моль) образуется при окислении SO2 озоном или при разложении SO4. Соед. SO4 и S2 O7 содержат пероксидную группировку —О—О—, формально им соответствуют пероксомоносерная к-та (к-та Каро) H2SO5 (т. пл. 47°С, с разл.) и пероксодисерная к-та Н2S2О8 (т. пл. 65 °С, с разл.), к-рые образуются при электролизе H2SO4 или гидросульфатов при произ-ве Н2О2. Известны также S6O и S7O2.
С галогенами, кроме I2, сера образует серы галогениды, с водородом - сероводород, сульфаны, с углеродом - сероуглерод, с металлами и более электроположит., чем сера, неметаллами-сульфиды (см. Сульфиды неорганические), с Se-фазу с широкой областью гомогенности (50-60% ат. % Se), с Те при сверхвысоких давлениях-Te7S10. Известны нитриды серы: циклич. S4 N4, к-рый при нагр. над Ag превращается в др. соед., молекулы к-рого представляют собой плоские циклы S2N2; (SN)x (образуется при полимеризации S2N2)-золотистое в-во с металлич. проводимостью, вблизи 0 К-сверхпроводник; S4N2 и др. Известны соед., содержащие серу в катионной форме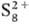 ,
,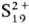 и др. Циклич. молекулы Sn м. б. лигандами, как, напр., в соед. K2[Pt(S5)3]. О к-тах серы, их солях см. Политионаты, Серная кислота, Сульфаты неорганические, Сульфиты неорганические, Тиосульфаты неорганические и др.,-об орг. соединениях серы-Сераорганические соединения и др.
и др. Циклич. молекулы Sn м. б. лигандами, как, напр., в соед. K2[Pt(S5)3]. О к-тах серы, их солях см. Политионаты, Серная кислота, Сульфаты неорганические, Сульфиты неорганические, Тиосульфаты неорганические и др.,-об орг. соединениях серы-Сераорганические соединения и др.
Получение. Серу добывают из самородных руд, а также получают окислением H2S или восстановлением SO2. Существует неск. методов добычи. серы из руд: 1) геотехнологический метод переработки самородной серы заключается в выплавке серы, находящейся в недрах Земли, без подъема руды на пов-сть. В серосодержащий пласт подают под давлением по трубам водяной пар, сжатым воздухом расплавленную серу поднимают на пов-сть. 2) По термическому методу серу либо выплавляют из дробленой руды в камерных печах, либо возгоняют во вращающихся печах. 3) Экстракционный метод (применяется ограниченно) состоит в извлечении серы из руд сероуглеродом. 4) Пароводяной метод (для руд с высоким содержанием серы) заключается в обработке дробленой руды в автоклавах острым Паром. 5) Флотационные методы предусматривают обогащение руд и затем извлечение серы пароводяным методом; вводятся реагенты для увеличения гидрофильности частиц руды и гидрофобности серы 6) При получении серы методом флокуляции концентрат поступает а плавильник, оттуда во флокулятор, где к образовавшейся суспензии добавляют коагулянт (высококипящая жидкость, содержащая воду), затем флокулы пустой породы отделяют от жидкой серы.
Серу получают из H2S пром. газов (генераторный, коксовый, газы нефтепереработки) и прир. газов: 1) извлекают H2S из газа щелочными р-рами, затем перерабатывают десорбиро-ванный H2S методом контактного окисления-часть H2S окисляется до SO2 (сгорание), после чего смесь H2S и SO2 реагирует на слое боксита при 270-300 °С, давая серу и Н2О. 2) В процессе сухой очистки газа H2S на фильтре с активир. углем окисляется при 40 °С до серы и Н2О.
Из SO2 серу получают в сочетании с выплавкой Fe и Си из сульфидных руд. В печи в шихте (руда, кокс, кварц, известняк) вначале отщепляется один атом S от FeS2, затем FeS окисляется с образованием SO2, к-рый восстанавливается коксом до серы. Газ, выходящий при ~ 450 °С, содержит пары S, SO2, COS, CS2, H2 S; его очищают от пыли и направляют в первый контактный аппарат, где на боксите при 450 °С COS и CS2 реагируют с SO2 с выделением серы. При переработке SO2 из отходящих газов цинкового (из ZnS) и др. произ-в также получают серу.
Сорта серы: выплавленную из самородных руд серу наз. природной комовой, полученную из H2S и SO2-гaзовой комовой, природную комовую, очищенную пере-гонкой,-рафинированной, сконденсированную из паров выше т-ры плавления и разлитую из жидкого состояния в формы-черенковой, сконденсированную в твердое состояние-серным цветом. Высокодисперсную серу наз. коллоидной.
Для рафинирования серы используют хим. методы-путем перевода примесей в др. степени окисления с послед. их отделением. Для уменьшения содержания As и Se серу обрабатывают смесью конц. HNO3 и H2SO4, отмывают от к-т, кипятят с обратным холодильником и сублимируют в вакууме. Для очистки от углерода (битумов) используют хим.-термич. метод-нагревают серу в кварцевом реакторе при ~ 800 °С, при этом углеродсодержащие в-ва обугливаются и легко отделяются.
Глубокую очистку серы в осн. осуществляют дистилляцией и ректификацией. Для дальнейшей очистки серы от примесей (Н, С, О, Se, As и др.) перспективны кристаллизац. методы, среди них-способ противоточной кристаллизации из расплава. Получена высокочистая сера с содержанием примесей 10-5-10-6 % по массе.
Определение. Качественно и количественно серу определяют путем перевода в р-римые сульфаты, а затем в BaSO4. Прир. объекты обрабатывают соляной к-той, затем отгоняют Н2 S. Свободную серу извлекают бензолом, пиритную-разб. HNO3, в составе орг. соед.-смесью HNO3 с КМnО4. Для определения серы в сталях и ферросплавах пробу раств. в смеси соляной и азотной к-т, затем Fe(III) переводят в Fe(II), удаляют NО-3 , определяют серу в виде BaSO4. В воздухе серу определяют колориметрически-сжигают серу в токе О2, окисляют образовавшийся SO2 до Н2 SO4 и определяют ее в виде BaSO4 в водно-спиртовом р-ре. Для определения малых кол-в (10-4 %) серы применяют фотоколориметрич. метод-после обработки пробы с получением H2S, поглощение H2S р-ром щелочи, серу определяют по изменению окраски метиленового синего.
Применение. Ок. 50% производимой серы используют для произ-ва H2SO4, ок. 25%-для получения сульфитов, 10-15%-для борьбы с вредителями с.-х. культур (гл. обр. винограда и хлопчатника), ок. 10%-в резиновой пром-сти (как вулканизующий агент). Серу применяют в произ-ве красителей, ВВ, искусств. волокна, люминофоров, CS2, сульфидов, в орг. синтезе и др., она входит в состав головок спичек, мазей для лечения кожных заболеваний. Небольшие добавки серы улучшают обрабатываемость автоматных сталей и анти-фрикц. св-ва спеченных антифрикц. материалов.
Мировое произ-во серы 53 млн. т (1984).
Соединения серы по отрицат. воздействию на окружающую среду занимают одно из первых мест среди загрязняющих в-в. Осн. источник загрязнения соединениями серы-сжигание угля и нефтепродуктов. 96% серы поступает в атмосферу в виде SO2, остальное кол-во приходится на сульфаты, H2S, CS2, COS и др. В виде пыли элементная сера раздражает органы дыхания, слизистые оболочки, может вызывать экземы и др. ПДК в воздухе 0,07 мг/м3 (аэрозоль, класс опасности 4). Мн. соед. S токсичны.
Сера известна с глубокой древности, ее начали использовать ок. 2000 до н. э.; напр., в Египте ее применяли для дезинфекции, беления тканей и др.
Лит.: Авдеева А. А., в сб.: Основы металлургии, т. 5, М., 1968, с. 483-504; Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971; Гусев А. И., Симонова Л.Н., Аналитическая химия серы, М., 1975; Глобальный биогеохимический цикл серы и влияние на него деятельности человека, М., 1983; Чурбанов М.Ф., Скрипачев И. В., "Высокочистые вещества", 1988, № 3, с. 92-107. И. Н. Один.
