Оксиды
ОКСИДЫ, соединения элементов с кислородом. В оксидах степень окисления атома кислорода —2. К оксидам относятся все соед. элементов с кислородом, кроме содержащих атомы О, соединенные друг с другом (пероксиды, надпероксиды, озо-ниды), и соед. фтора с кислородом (OF2 и др.). Последние следует называть не оксидами, а фторидами кислорода, т. к. степень окисления кислорода в них положительная.
При комнатной т-ре большинство оксиды-твердые в-ва (СаО, Fe2O3 и др.), нек-рые-жидкости (Н2О, Сl2О7 и др.) и газы (NO, SO2 и др.). Хим. связь в оксидах-ионная и ионно-ковалент-ная. Т-ры плавления и кипения оксидов понижаются с возрастанием в них доли ковалентной связи. Многим оксидам в твердом состоянии присущ полиморфизм. Нек-рые оксиды элементов III, IV, V гр. (напр., В, Si, As, Р) образуют рентгеноаморфные стекла. Оксиды s- и p-элементов (напр., MgO, Аl2О3, SiO2)-диэлектрики, оксиды переходных металлов (Fe, Сг и др.) часто обладают св-вами полупроводников. Нек-рые оксиды-пьезоэлектрики (напр., кварц), ферромагнетики [оксиды Fe, Cr(IV) и др.]. Вследствие своей многочисленности, разнообразия св-в и доступности оксиды представляют исключительно важный класс неорг. в-в.
Большинство оксидов-солеобразующие; при солеобразовании, протекающем обычно при нагр. (напр., Na2O + SiO2  Na2SiO3), степени окисления элементов не изменяются. Известно неск. несолеобразующих оксидов (напр., NO), не вступающих в подобные р-ции. Солеобразующие оксиды подразделяют на основные, кислотные и амфотерные. Элемент основного оксида (Li2O, BaO и др.) при образовании соли (напр., ВаО + SO3
Na2SiO3), степени окисления элементов не изменяются. Известно неск. несолеобразующих оксидов (напр., NO), не вступающих в подобные р-ции. Солеобразующие оксиды подразделяют на основные, кислотные и амфотерные. Элемент основного оксида (Li2O, BaO и др.) при образовании соли (напр., ВаО + SO3  BaSO4) становится катионом, элемент кислотного оксида (напр., SO3, NO2, P2O5) входит в состав кислородсодержащего аниона соли. Амфотерные оксиды (напр., ZnO, BeO, А12О3) могут реагировать и как основные оксиды, и как кислотные, напр.:
BaSO4) становится катионом, элемент кислотного оксида (напр., SO3, NO2, P2O5) входит в состав кислородсодержащего аниона соли. Амфотерные оксиды (напр., ZnO, BeO, А12О3) могут реагировать и как основные оксиды, и как кислотные, напр.:
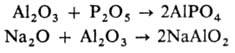
Уменьшение степени окисления элемента и увеличение радиуса его иона делает оксид более основным, наоборот, увеличение степени окисления и уменьшение ионного радиуса-более кислотным (напр., МnО- основной оксид, Мn2О7-кислотный). Многие оксиды, напр. Рb3О4, Fe3O4, содержащие элемент в разных степенях окисления, являются двойными оксидами: (PbII2, PbIV)O4, (FeII, FeIII2)O4. Среди оксидов, особенно среди оксидов d-элементов, много нестехиометрич. соединений.
Оксиды щелочных и щел.-зем. металлов активно реагируют с водой, образуя щелочи, напр.: К2О + Н2О 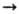 2КОН; нек-рые кислотные оксиды -ангидриды неорганических кислот-активно взаимод. с водой, давая к-ты, напр.: SO3 + Н2О
2КОН; нек-рые кислотные оксиды -ангидриды неорганических кислот-активно взаимод. с водой, давая к-ты, напр.: SO3 + Н2О H2SO4. Большинство оксидов металлов в компактном состоянии при комнатной т-ре с водой не реагируют. Основные оксиды обычно быстро реагируют с к-тами в р-ре с образованием солей, напр.:
H2SO4. Большинство оксидов металлов в компактном состоянии при комнатной т-ре с водой не реагируют. Основные оксиды обычно быстро реагируют с к-тами в р-ре с образованием солей, напр.:
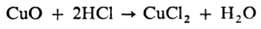
Восстановители (С, Н2, активные металлы, в частности Mg, Al) при нагр. восстанавливают многие оксиды до металла, напр.:
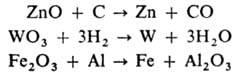
При сильном нагревании оксидов с углеродом часто образуются карбиды (напр., СаО + ЗС 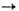 СаС2 + СО), при хлорировании смеси оксидов с углем-хлориды (напр., В2О3 + ЗС + + ЗСl2
СаС2 + СО), при хлорировании смеси оксидов с углем-хлориды (напр., В2О3 + ЗС + + ЗСl2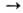 2ВСl3 + 3СО).
2ВСl3 + 3СО).
Оксиды широко распространены в природе. В очень больших кол-вах встречаются Н2О и SiO2. Мн. минералы являются оксидами (гематит Fe2O3, магнетит Fe3O4, касситерит SnO2 и др.).
Многие оксиды образуются при взаимод. простых в-в с кислородом (Li2O, СаО, La2O3, SO2 и др.). Оксиды металлов обычно получают термич. разложением гидроксидов, карбонатов, нитратов и др. солей кислородсодержащих к-т (напр., СаСО3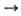 СаО + СО2), анодным окислением металлов, оксиды неметаллов - окислением кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О2
СаО + СО2), анодным окислением металлов, оксиды неметаллов - окислением кислородом водородсодержащих соед. неметаллов (напр., 2H2S 4+ 3О2 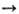 2SO2 + 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2О3, MgO, SO3, CO, CO2, NO и другие оксиды. Используют оксиды как огнеупоры (SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2-сшгака-гель, Аl2О3 и др.), катализаторы (V2O5, Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора, фаянса, магн. материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn и др.)-сырье в произ-ве металлов, оксиды неметаллов (напр., S, Р, N)- в произ-ве соответствующих к-т.
2SO2 + 2H2O). В пром-сти в больших кол-вах получают СаО, Аl2О3, MgO, SO3, CO, CO2, NO и другие оксиды. Используют оксиды как огнеупоры (SiO2, MgO, Al2O3 и др.), адсорбенты (SiO2-сшгака-гель, Аl2О3 и др.), катализаторы (V2O5, Al2O3 и др.), в произ-ве строит. материалов, стекол, фарфора, фаянса, магн. материалов, пьезоэлектриков и др. Оксиды металлов (Fe, Ni, Al, Sn и др.)-сырье в произ-ве металлов, оксиды неметаллов (напр., S, Р, N)- в произ-ве соответствующих к-т.
С. И. Дракин.
