Соли
СОЛИ, класс хим. соединений. Общепринятого определения понятия "соли", так же как и терминов "кислоты и основания", продуктами взаимод. к-рых соли являются, в настоящее время не существует. Соли могут рассматриваться как продукты замещения протонов водорода к-ты на ионы металлов,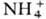
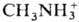 и др. катионы или групп ОН основания на анионы к-т (напр., Сl-,
и др. катионы или групп ОН основания на анионы к-т (напр., Сl-,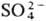 ). Продуктами полного замещения являются средние соли, напр. Na2SO4, MgCl2, неполного - кислые или основные соли, напр. KHSO4, CuClOH. Различают также простые соли, включающие один вид катионов и один вид анионов (напр., NaCl), двойные соли, содержащие два вида катионов [напр., KAl(SO4)2·12H2O], смешанные соли, в составе к-рых два вида кислотных остатков (напр., AgClBr). Комплексные соли (см. Координационные соединения)содержат комплексные ионы, напр. K4[Fe(CN)6]. Т. наз. внутренние соли, напр. бетаин (CH3)3NCH2COO-, представляют собой биполярные ионы.
). Продуктами полного замещения являются средние соли, напр. Na2SO4, MgCl2, неполного - кислые или основные соли, напр. KHSO4, CuClOH. Различают также простые соли, включающие один вид катионов и один вид анионов (напр., NaCl), двойные соли, содержащие два вида катионов [напр., KAl(SO4)2·12H2O], смешанные соли, в составе к-рых два вида кислотных остатков (напр., AgClBr). Комплексные соли (см. Координационные соединения)содержат комплексные ионы, напр. K4[Fe(CN)6]. Т. наз. внутренние соли, напр. бетаин (CH3)3NCH2COO-, представляют собой биполярные ионы.
Типичные соли -кристаллич. в-ва с ионной структурой, напр. CsF (см. Ионная связь, Ионные кристаллы). Существуют также ковалентные соли, напр. А1Сl3 (см. Ковалентные кристаллы). В действительности характер хим. связи у многих солей - смешанный. О правилах образования названий солей см. Номенклатура химическая.
По р-римости в воде различают растворимые, мало растворимые и практически нерастворимые соли. К р-римым относятся почти все соли натрия, калия и аммония, мн. нитраты, ацетаты и хлориды, за исключением солей поливалентных металлов, гидролизующихся в воде, мн. кислые соли.
В водных р-рах соли полностью или частично диссоциируют на ионы (см. Электролитическая диссоциация). Соли слабых к-т и(или) слабых оснований подвергаются при этом гидролизу. Водные р-ры солей содержат гидратир. ионы (см. Гидратация), ионные пары и более сложные хим. формы, включающие продукты гидролиза и др. Ряд солей раств. также в спиртах, ацетоне, амидах к-т и др. орг. р-рителях.
Из водных р-ров соли могут кристаллизоваться в виде кристаллогидратов (см. Гидраты), из неводных-в виде кристаллосольватов, напр. СаВr2·3С2Н5ОН (см. Сольваты). Р-ры солей взаимод. с металлами, стандартные электродные потенциалы к-рых более отрицательны, чем потенциал металла, входящего в состав соли:
Zn + Hg(NO3)2(p_p) : Zn(NO3)2(p-p) + Hg
Из хорошо р-римых солей слабых к-т более сильные к-ты вытесняют более слабые:
CH3COONa + HCl(p-p) : CH3COOH + NaCl
Из хорошо р-римых солей слабых оснований более сильные р-римые основания вытесняют более слабые:
АlСl3(р_р) + 3NаОН(p-р) : А1(ОН)3 + 3NaCl(p-p)
В водно-солевых системах между солями могут протекать обменные р-ции, процессы образования труднорастворимых или комплексных солей:
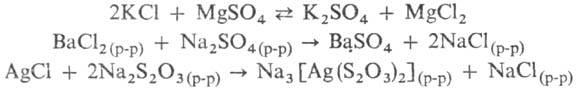
Данные о разл. процессах, протекающих в водно-солевых системах, о р-римости солей при их совместном присутствии в зависимости от т-ры, давления и концентрации, о составе твердых и жидких фаз м. б. получены при изучении диаграмм р-римости водно-солевых систем (рис. 1, 2; см. также Растворы, Физико-химический анализ).
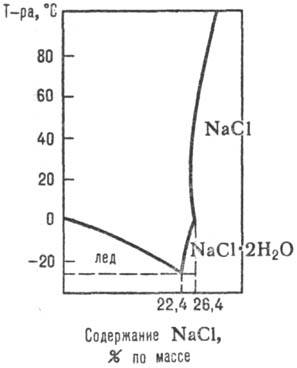
Рис. 1. Диаграмма р-римости системы NaCl-H2O.
Общие способы синтеза солей. Взаимод. к-т и оснований (р-ция нейтрализации, ур-ние 1), а также к-т с основными оксидами (2) и оснований с кислотными оксидами (3) или кислотных и основных оксидов (4):
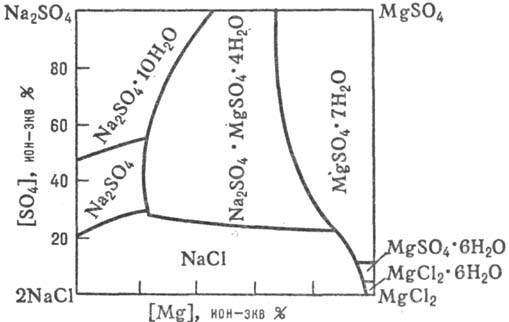
Рис. 2. Диаграмма р-римости "морской" системы 2NaCl + MgSO4
 MgCl2 + Na2SO4 в воде при 25 °C.
MgCl2 + Na2SO4 в воде при 25 °C.
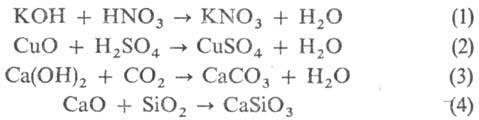
Следует отметить, что продукты взаимод. оснований и к-т Льюиса (см. Кислоты и основания) отличаются от обычных солей и по отношению к ним применяют назв. "кислотно-основной комплекс" или "аддукт". Обменное взаимод. между к-той и солью или основанием и солью (5,6):
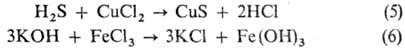
Взаимод. двух разл. солей (7), металлов с к-тами (8), металлов с неметаллами (9), металлов с солями (10):
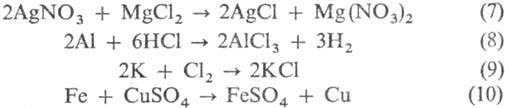
Сырьем для пром. получения ряда солей-хлоридов, сульфатов, карбонатов, боратов Na, К, Са, Mg служат морская и океанич. вода, прир. рассолы, образующиеся при ее испарении, и твердые залежи солей (см. Галургия). Для группы минералов, образующих осадочные солевые месторождения (сульфатов и хлоридов Na, К и Mg), применяют условное назв. "природные соли". Наиб. крупные месторождения калиевых солей находятся в России (Соликамск), Канаде и ФРГ, мощные залежи фосфатных руд-в Северной Африке, России и Казахстане, NaNO3-B Чили.
Соли используют в пищ., хим., металлургич., стекольной, кожевенной, текстильной пром-сти, в с. х-ве, медицине и т. д.
См. также Бораты неорганические, Галогениды, Карбонаты неорганические, Нитраты неорганические, Сульфаты неорганические, Фосфаты неорганические и др.
Лит.: Позин М. E., Технология минеральных солей, 4 изд., ч. 1 -2, Л., 1974; Бацанов С. С., Экспериментальные основы структурной химии, М., 1986, с. 195-226; Ксензенко В. И., Кононова Г. Н., Теоретические основы процессов переработки галургического сырья, М., 1982, с. 11-211. В. П. Данилов.
