Галогениды
ГАЛОГЕНИДЫ, хим. соед. галогенов с др. элементами. К галогенидам обычно относят соед., в к-рых атомы галогена имеют большую электроотрицательность, чем др. элемент. Галогенидов не образуют Не, Ne и Аг. К простым, или бинарным, галогенидам ЭХn (n-чаще всего целое число от 1 у моногалогенидов до 7 у IF7 и ReF7, но м. б. и дробным, напр. 7/6 у Bi6Cl7) относят, в частности, соли галогеноводородных к-т и межгалогенные соединения (напр., галогенфториды). Существуют также смешанные галогениды, полигалогениды, гидрогалогениды, оксогалогениды, оксигалогениды, гидроксогалогениды, тиогалогениды и комплексные галогениды.
Степень окисления галогенов в галогенидах обычно равна — 1, в межгалогенных соед. у СЦ Вг, I она может быть + 1, 4- 3, + 5, а у I в IF7 +7.
По характеру связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные. В действительности связи имеют смешанный характер с преобладанием вклада той или иной составляющей. Галогениды щелочных и щел.-зем. металлов, а также многие моно- и дигалогениды др. металлов-типичные соли, в к-рых преобладает ионный характер связи. Большинство из них относительно тугоплавки и малолетучи, хорошо растворимы в воде; в водных р-рах почти полностью диссоциируют на ионы. Св-вами солей обладают также тригалогениды Р3Э. Р-римость в воде ионных галогенидов, как правило, уменьшается от иодидов к фторидам. Хлориды, бромиды и иодиды Ag+ , Сu+, Hg+ и Pb+ плохо растворимы в воде.
Увеличение числа атомов галогенов в галогенидах металлов или отношения заряда металла к радиусу его иона приводит к повышению ковалентной составляющей связи, снижению р-римости в воде и термич. устойчивости галогенидов, увеличению его летучести, повышению окислит. способности и склонности к гидролизу. Эти зависимости наблюдаются для галогенидов металлов одного и того же периода и в ряду галогенидов одного и того же металла. Их легко проследить на примере термич. св-в. Напр., для галогенидов металлов 4-го периода т-ры плавления и кипения составляют соотв. 771 и 1430°С для КС1, 772 и 1960°С для СаС12, 967 и 975 °С для ScCK, - 24,1 и 136°С для Т1С14. Для UF3 т. пл. ~ 1500°С, UF4 1036 °С, UF5 348 °С, UF6 64,0 °С В рядах соед. ЭХn при неизменном п ковалентность связи обычно увеличивается при переходе от фторидов к хлоридам и уменьшается при переходе от последних к бромидам и иодидам. Так, для A1F3 т. возг. 1280°С, А1С13 180°С, т. кип. А1Вг3 254,8 °С, АlI3 407 °С. В ряду ZrF4, ZrCl4, ZrBr4, ZrI4 т-ра возгонки равна соотв. 906, 334, 355 и 418°С. В рядах MF,, и МС1„, где М-металл одной подгруппы, ковалентность связи уменьшается с ростом атомной массы металла. Фторидов и хлоридов металлов с примерно одинаковым вкладом ионной и ковалентной составляющей связи немного.
Галогениды неметаллов более ковалентны, чем галогениды металлов. Так, т-ры возгонки SiF4 ( - 95 °C и GeF4 ( - 36 °C гораздо ниже, чем у TiF4 и ZrF4, также и т-ры кипения SiCl4 (57,0 °С) и GeCl4(83,12°C) ниже, чем у Т1С14 и ZrCl4. Ковалентные SiF4 и GeF4, в отличие от TiF4 и ZrF4, почти мгновенно гидролизуются водой.
Средняя энергия связи элемент - галоген уменьшается при переходе от фторидов к иодидам и с повышением п (см. табл.).
ЭНЕРГИЯ СВЯЗИ В НЕКОТОРЫХ ГАЗООБРАЗНЫХ ГАЛОГЕНИДАХ, кДж/моль 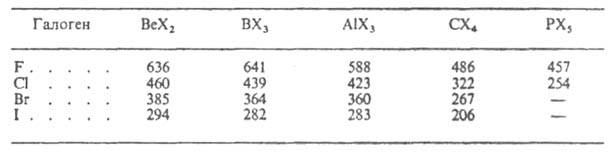
К смешанным галогенидам, содержащим наряду с атомами к.-л. элемента атомы двух или большего числа галогенов, относятся, напр., хлоропентафторид серы SC1F5, бромохлороди-фторид углерода CBrClF2, к межгалогенным соед. ХХn' (п = = 1, 3, 5 или 7)-ClF, BrF3, BrF5, IF7 и др. Полигалогениды содержат анионы Хn- (X == Вг, I; п = 3, 5, 9), напр. КВr3, К19. Гидрогалогениды МНn Хn+1 , или МНn Хn+2 - продукты присоединения галогеноводородов к галогенидам металлов; содержат ионы HnX-n+1. Наиболее устойчивы гидрофториды металлов.
Многие металлы и неметаллы образуют галогениды, содержащие изолированные или мостиковые атомы О (соотв. оксо-и оксигалогениды), напр. оксотрифторид ванадия VOF3, диоксифторид ниобия NbO2F, диоксодииодид вольфрама WO2I2, карбонилгалогениды СОХ2, нитрилгалогениды NO2X, нитрозилгалогениды NOX, тионилгалогениды SOX2. Характер связей элементов с галогенами в окси-и оксогалогенидах неметаллов более ковалентный, чем в соответствующих соед. металлов.
Комплексные галогениды (галогенометаллаты) содержат комплексные анионы, в к-рых атомы галогенов являются лигандами, напр. гексахлороплатинат(IV) калия K2[PtCl6], гептафторотанталат(V) натрия Na[TaF7], гексафтороарсенат(V) лития Li[AsF6]. наиб. термич. устойчивостью обладают фторо-, оксофторо- и хлорометаллаты. По характеру связей к комплексным галогенидам близки ионные соед. с катионами NF4+, N2F3+, C1F2+, XeF+ и др.
Для многих галогенидов характерны ассоциация и полимеризация в жидкой и газовой фазах с образованием мостиковых связей. наиб. склонны к этому галогениды металлов I и II групп, А1С13, пентафториды Sb и переходных металлов, оксофториды состава MOF4. Известны галогениды со связью металл - металл, напр. Hg2Cl2.
Фториды значительно отличаются по св-вам от др. галогенидов. Однако в простых галогенидах эти отличия выражены менее резко, чем в самих галогенах, а в комплексных галогенидах-слабее, чем в простых.
Многие ковалентные галогениды (особенно фториды)-сильные к-ты Льюиса, напр. AsF5, SbF5, BF3, A1C13. Фториды входят в состав сверхкислот. Высшие галогениды восстанавливаются металлами и Н2, напр.: 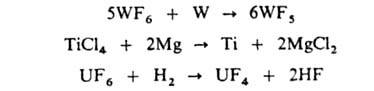
Галогениды металлов V-VIII групп, кроме Сr и Мn, восстанавливаются Н2 до металлов, напр.:
WF6 + 3Н2 -> W + 6HF
Многие ковалентные и ионные галогениды металлов взаимодействуют между собой с образованием комплексных галогенидов, напр.:
КС1 + ТаС15 -> К[ТаС16]
Более легкие галогены могут вытеснять более тяжелые из галогенидов. Кислород может окислять галогениды с выделением С12, Вr2 и I2. Одна из характерных р-ций ковалентных галогенидов-взаимод. с водой (гидролиз) или ее парами при нагр. (пирогидролиз), приводящее к образованию оксидов, окси- или оксогалогенидов, гидроксидов и галогеноводородов. Исключение составляют CF4, CC14 и SF6, устойчивые к парам воды при высоких т-рах.
Галогениды получают непосредственно из элементов, взаимод. галогеноводородов или галогеноводородных к-т с элементами, оксидами, гидроксидами или солями, а также обменными р-циями.
Галогениды широко используют в технике как исходные в-ва для получения галогенов, щелочных и щел.-зем. металлов, как компоненты стекол и др. неорг. материалов; они являются промежут. продуктами в произ-ве редких и нек-рых цветных металлов, U, Si, Ge и др.
В природе галогениды образуют отдельные классы минералов, в к-рых представлены фториды (напр., минералы флюорит, криолит) и хлориды (сильвин, карналлит). Бром и иод входят в состав нек-рых минералов в виде изоморфных примесей. Значительные кол-ва галогенидов содержатся в воде морей и океанов, в соляных и подземных рассолах. Некоторые галогениды, напр. NaCl, К.С1, СаС12, входят в состав живых организмов.
О псевдогалогенидах см., напр., Галогены, об орг. галогенидах-Галогенангидриды карбоновых кислот, Галогензамещенные углеводородов. Э.Г. Раков.
