Галогены
ГАЛОГЕНЫ (от греч. hals, род. падеж halos - соль и -genes-рождающий, рождённый) (галоиды), хим. элементы главной подгруппы VII гр. периодич. системы: фтор, хлор, бром, иод и астат. Молекулы двухатомны. Внеш. электронная оболочка атомов имеет конфигурацию s2p5. С увеличением ат. массы галогенов возрастают их ионный и ковалентный радиусы, уменьшаются энергии ионизации и электроотрицательность (см. табл.).
ХАРАКТЕРИСТИКА ГАЛОГЕНОВ 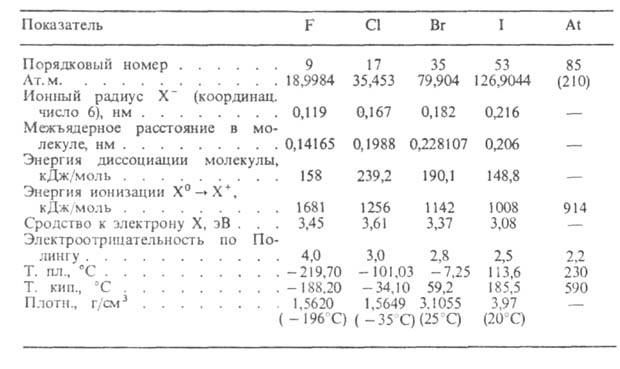
Галогены характеризуются наибольшими среди всех элементов значениями сродства к .электрону. наиб. электроотрицателен фтор. Сродство атомов галогенов к электрону и энергия диссоциации молекул возрастают от фтора к хлору, а затем уменьшаются к иоду.
Степени окисления галогенов: — 1 (наиб. характерная); + 1 (НОF, НХО и др.); + 3 у С1 и Вr (НХО2, XF3); + 4 у С1, Вr, I (ХO2); + 5 (НХO3, XF5 и др.); + 6 у С1 (С12Об); + 7 у С1, Вr и I (HC1O4, C12O7, НВrO4, IF7 и др.).
При обычных условиях F2 и С12-газы, Вr2-жидкость, I2 и At2- твердые в-ва. С увеличением ат. массы окраска галогенов становится более интенсивной - от бледно-желтой у фтора до темно-красной у брома и темно-фиолетовой у иода. В твердом состоянии галогены образуют молекулярные кристаллы. Жидкие галогены-диэлектрики. Все галогены, кроме фтора, раств. в воде; иод раств. хуже, чем хлор и бром; F2 окисляет воду до О2, О3 и фторидов кислорода. В водных р-рах С12 и Вr2 образуют гидраты Х2*nН2О и гипогалогенитионы ОХ- ; Вr2 и I2 хорошо раств. в СНС13, CS2, этаноле и др. орг. р-рителях.
Невысокие энергии диссоциации молекул галогенов (существенно меньшие, чем у О2, Н2 и N2) и большое сродство атомов к электрону определяют их высокую реакц. способность. Галогены-сильные окислители. наиб. активен фтор, образующий соед. со всеми хим. элементами, кроме Не, Ne и Аr. Реакц. способность галогенов убывает с увеличением ат. массы и обычно возрастает в присут. влаги и других галогенов. Водород с галогенами образует галогеноводороды НХ. Энтальпии их образования очень мало зависят от т-ры и уменьшаются от HF к HI. Термич. устойчивость в этом ряду также уменьшается. Р-ры НС1, НВг и HI в воде - сильные к-ты, р-р HF-к-та средней силы. См. также Бромистый водород, Йодистый водород, Соляная кислота, Фтористый водород.
С металлами и неметаллами галогены образуют галогениды, друг с другом-межгалогенные соединения. С кислородом С12, Вr2 и I2 дают оксиды, F2-фториды кислорода. Все галогены (кроме фтора) образуют неустойчивые кислородсодержащие к-ты НХО, НХО2, НХО3 и НХО4; их кислотные св-ва в указанном ряду усиливаются, а окислит. активность убывает. Особые группы соед.-гидрогалогениды (среди к-рых наиб. устойчивы гидрофториды металлов), напр. М Н2Х3, и полигалогениды, напр. K[C1F2].
Фтор вытесняет хлор из его соед. с более электроположит. элементами, хлор вытесняет бром, а бром-иод (1/2 F2 + Cl- -> F- + 1/2C12). С др. стороны, иод вытесняет бром и хлор из кислородсодержащих к-т и их солей, в к-рых галогены заряжены положительно (1/2I2 + [СIO3]- -> [IO3]- + 1/2Сl2). Высшие степени окисления мн. хим. элементов стабилизируются фтором. Известны, напр., NiF3, AuF5, ReF7, криптона дифторид, ксенона фториды, соединения, содержащие в молекуле катион NF+4, анион FeFg62-, CoFg62-. Галогены взаимод. со многими орг. соед., замещая атомы Н, присоединяясь по кратным связям или разлагая орг. в-ва до галогенопроизводных метана. Мн. углеводороды горят или взрываются в атмосфере F2.
Ионы галогенов в виде лигандов входят в состав молекул многочисленных комплексных соед., фтор и хлор участвуют в образовании мостиковых связей, напр. в А12С1б, Ta4F20. наиб. активны атомарные и ионизированные галогены, к-рые получают в плазме, газовых разрядах или термокаталитич. разложением молекул Х2 и используют для синтеза термически нестойких галогенидов или ионного травления пов-стей металлов, полупроводниковых материалов.
Галогены (за исключением астата) широко распространены в природе; они входят в состав мн. минералов, содержатся в морской воде; в своб. виде не встречаются. Все галогены ядовиты и обладают бактерицидными св-вами.
Соединения, напоминающие по хим. св-вам галогены, напр. дициан (CN)2, диоксоциан (CON)2, дитиоциан (SCN)2, наз. псевдогалогенами, а соли металлов, содержащие группы CN, CON, SСN,-псевдогалогенидами. Э.Г. Раков.
