Кратные связи
КРАТНЫЕ СВЯЗИ, хим. связи двухцентрового типа, к-рые в отличие от простой связи образованы более чем одной парой электронов. По числу пар электронов, образующих кратные связи, различают двойные, тройные и четверные связи. В приближении молекулярных орбиталей методов кратные связи сопоставляются с мол. орбиталями, к-рые по св-вам симметрии делят на s-, p- и d-орбитали. p-Орбитали антисимметричны относительно плоскости, проходящей через связь. В многоатомных молекулах эта плоскость является общей для всей молекулы или для мол. фрагмента, включающего эту связь. d-Орбитали антисимметричны относительно двух взаимно перпендикулярных плоскостей, проходящих через связь. При образовании кратных связей возникает, как правило, одна (или более) s-орбиталь и обязательно хотя бы одна p- или d-орбиталь. По этой причине составляющие кратных связей, определяемые p- или d-орбиталями, наз. соотв. p- или d-связями. Атомы непереходных элементов в молекулах и ионах м. б. связаны простой, двойной и тройной связями. Образование простой d-связи С—С в молекуле этана соотносят с перекрыванием двух sp3-гибридных орбиталей атомов углерода. В молекуле этилена кроме s-связи С—С присутствует одна, а в молекуле ацетилена с тройной связью - две p-связи: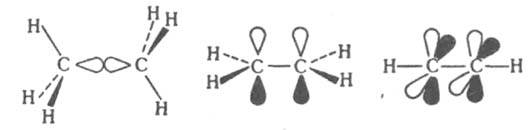
Четверная связь (и м. б. связи более высокой кратности) характерна только для переходных металлов. d-Перскрываниe ведет к образованию четверных связей в солях октагалогеиодиренат-аниона Re2Hal82-, карбоксилатах молибдена и вольфрама M(OOCR)4, внутрикомплексных соед. хрома и ванадия М2А2, где А - 2,6-диметоксифенил. Энергетич. вклады, приходящиеся на связи разл. типов, неравноценны. Обычно энергия p-связи составляет в среднем около 80% энергии s-связи, а вклад d-связи оценивается, напр., в солях октахлородиренат-аниона всего в 14% от полной энергии связи. Чем выше кратность связи, тем больше ее прочность (энергия диссоциации), короче межатомное расстояние и больше силовая постоянная связи (см. табл.).

Две или больше кратные связи могут образовывать в хим. соединении системы кумулированных и сопряженных связей. В первом случае две двойные связи примыкают к одному и тому же атому как, напр., в аллене Н2С=С=СН2; во втором - двойные или (и) тройные связи разделены одной простой, как, напр., в 1,3-бутадиене Н2С=СН—СН=СН2 или акрилонитриле
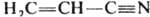 . В сопряженных системах кратность связи не м. б. определена целым числом. Мерой кратности связи (заселенности ее электронами) служит дробная величина порядка связи, расчет к-рой осуществляется обычно при помощи методов квантовой химии.
. В сопряженных системах кратность связи не м. б. определена целым числом. Мерой кратности связи (заселенности ее электронами) служит дробная величина порядка связи, расчет к-рой осуществляется обычно при помощи методов квантовой химии. Литература
Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975; Коттон Ф. А., Уолтон Р., Кратные связи металл — металл, пер. с англ., М., 1985.
Синонимы/примеры:*
Двойные связи; Тройные связи
*подобраны ИИ, возможны неточности
Ещё по теме
Кратные связи в химии — типы и примеры
Простая ковалентная связь в химии
Ковалентная связь — особенности и роль в химии
Тройная связь в химии
Гибридизация орбиталей и химические связи
Двойная связь в химии — строение и свойства
Органические соединения
Сопряжение простых и кратных связей в органической химии
Природа ненасыщенных соединений и теория химического строения
Сопряжение связей в органической химии
Химическая связь
Сопряжение связей в химии — основные аспекты и применение
Гетерополярные химические связи — типы и особенности
σ- и π-связи — электронные представления и отличия
Сигма- и пи-связи в химии
