Орбиталь
ОРБИТАЛЬ (от лат. orbita-путь, колея), волновая ф-ция, описывающая состояние одного электрона в атоме, молекуле или др. квантовой системе. В общем случае квантовохим. термин "орбиталь" используется для любой ф-ции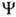 , зависящей от переменных х, у, z одного электрона. В рамках молекулярных орбиталей методов для электронных состояний молекул часто используют приближенное описание квантовой системы как целого, задавая состояние электрона в усредненном поле, созданном ядрами и остальными электронами системы. При этом орбиталь
, зависящей от переменных х, у, z одного электрона. В рамках молекулярных орбиталей методов для электронных состояний молекул часто используют приближенное описание квантовой системы как целого, задавая состояние электрона в усредненном поле, созданном ядрами и остальными электронами системы. При этом орбиталь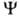 определяется одноэлектронным ур-ни-ем Шрёдингера с эффективным одноэлектронным гамильтонианом
определяется одноэлектронным ур-ни-ем Шрёдингера с эффективным одноэлектронным гамильтонианом 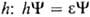 ; орбитальная энергия
; орбитальная энергия 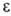 , как правило, соотносится с потенциалом ионизации (см. Купманса теорема). В зависимости от системы, для к-рой определена орбиталь, различают атомные, молекулярные и кристаллические орбитали.
, как правило, соотносится с потенциалом ионизации (см. Купманса теорема). В зависимости от системы, для к-рой определена орбиталь, различают атомные, молекулярные и кристаллические орбитали.
Атомные орбитали (АО) характеризуются тремя квантовыми числами: главным п, орбитальным / и магнитным ш. Значение l = 0, 1, 2,... задает квадрат орбитального (углового) момента электрона 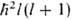 (
(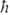 -постоянная Планка), значение m = l,l — 1,..., +1, 0, — 1,..., — l + 1, — l-проекцию момента на нек-рую выбранную ось z; n нумерует орбитальные энергии. Состояния с заданным / нумеруются числами п = l + 1, l + 2,... В сферич. системе координат с центром на ядре атома АО имеет форму
-постоянная Планка), значение m = l,l — 1,..., +1, 0, — 1,..., — l + 1, — l-проекцию момента на нек-рую выбранную ось z; n нумерует орбитальные энергии. Состояния с заданным / нумеруются числами п = l + 1, l + 2,... В сферич. системе координат с центром на ядре атома АО имеет форму 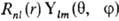 , где
, где 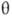 и
и 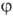 -полярные углы, r-расстояние от электрона до ядра. Rnl(r)наз. радиальной частью АО (радиальной ф-цией), a Ylm(q, j)-сферич. гармоникой. При поворотах системы координат сферич. гармоника заменяется на линейную комбинацию гармоник с одним и тем же значением l; радиальная часть АО при поворотах не меняется, и соответствующий этой АО энергетич. уровень (21 + 1)-кратно вырожден. Обычно
-полярные углы, r-расстояние от электрона до ядра. Rnl(r)наз. радиальной частью АО (радиальной ф-цией), a Ylm(q, j)-сферич. гармоникой. При поворотах системы координат сферич. гармоника заменяется на линейную комбинацию гармоник с одним и тем же значением l; радиальная часть АО при поворотах не меняется, и соответствующий этой АО энергетич. уровень (21 + 1)-кратно вырожден. Обычно 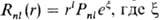 - показатель орбитальной экспоненты, а Рпl- полином степени (п — l — 1). В сокращенной записи АО описывают символом nlm, причем п обозначают цифрами 1, 2, 3,..., значениям l = 0, 1, 2, 3, 4,... отвечают буквы s, p, d, f, g,...; m указывают справа внизу, напр. 2p+1, 3d-2.
- показатель орбитальной экспоненты, а Рпl- полином степени (п — l — 1). В сокращенной записи АО описывают символом nlm, причем п обозначают цифрами 1, 2, 3,..., значениям l = 0, 1, 2, 3, 4,... отвечают буквы s, p, d, f, g,...; m указывают справа внизу, напр. 2p+1, 3d-2.
Более удобны АО, содержащие не комплексные сферич. гармоники, а их линейные комбинации, имеющие веществ. значения. Такие АО наз. кубическими (тессераль-ными). Они имеют вид 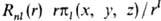 , где
, где 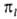 (х, y, z) - однородный полином (угловая ф-ция) степени l относительно декартовых координат электрона х, у, z с центром на ядре (направление осей произвольно); АО обозначают символами
(х, y, z) - однородный полином (угловая ф-ция) степени l относительно декартовых координат электрона х, у, z с центром на ядре (направление осей произвольно); АО обозначают символами 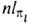 , напр.
, напр.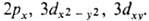
Если полином Pnl(r)определяется решением ур-ния Шрёдингера для электрона в кулоновском поле ядра, АО наз. водородоподобными. Наиб. употребительные водоро-доподобные кубич. АО приведены в таблице.
ВОДОРОДОПОДОБНЫЕ ОРБИТАЛИ s. p, d, f-ТИПОВ
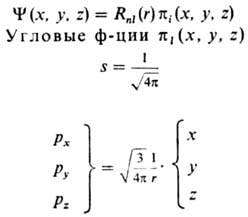

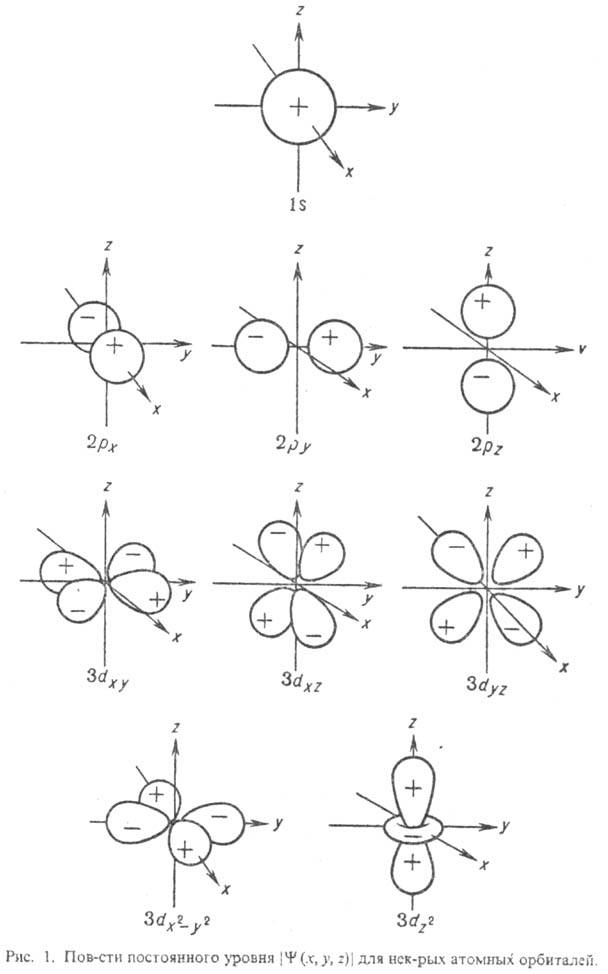
В хим. приложениях нередко приводят контуры АО, к-рые м. б. построены по-разному. Наиб. распространены т. наз. фазовые пов-сти, на к-рых изображают значения кубич. (или сферич.) гармоник: при заданных полярных углах модуль угловой части АО равен расстоянию до начала координат. На рис. 1 приведены другие, более наглядные пов-сти, на к-рых абс. величины нек-рых АО имеют постоянное значение. Оба способа изображения АО практически не различаются лишь вблизи начала координат. Во всех случаях знаками + и — (или штриховкой) указывают, какой знак имеет АО в данной области. Как и все волновые ф-ции, АО можно умножить на — 1, что приведет к изменению знака ф-ции, однако смысл имеют не знаки АО сами по себе, а чередование знаков для системы АО при описании мол. орбиталей. Графич. изображение АО не всегда имеет смысл. Так, квадраты модулей сферич. гармоник не зависят от угла 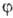 , поэтому изображение, напр., АО 2рх и 2ру будет совсем не похоже на изображение АО 2р+ и 2p-, хотя обе пары АО полностью эквивалентны.
, поэтому изображение, напр., АО 2рх и 2ру будет совсем не похоже на изображение АО 2р+ и 2p-, хотя обе пары АО полностью эквивалентны.
Молекулярные орбитали (МО) описывают электрон в поле всех ядер молекулы и усредненном поле остальных электронов. Как правило, МО не имеют простого аналит. представления и для них используют приближение линейной комбинации атомных орбиталей (см. ЛКАО-приближение). В методах мол. орбиталей многоэлектронная волновая ф-ция строится как произведение или определитель, составленный из спин-орбиталей, т.е. орбиталей, умноженных на спин-функцию  или
или  (см. Паули принцип).
(см. Паули принцип).
Для молекул с симметричной ядерной конфигурацией МО классифицируют по типам симметрии. Напр., МО любой молекулы с аксиальной симметрией, в т. ч. двухатомной молекулы, можно классифицировать по поведению относительно поворотов вокруг оси молекулы (как правило, оси z). Если -набор координат электрона, напр. цилиндрических, в к-ром выделен угол
-набор координат электрона, напр. цилиндрических, в к-ром выделен угол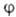 поворота вокруг оси, все МО можно представить в форме
поворота вокруг оси, все МО можно представить в форме 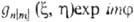 , где т = 0, b 1, b2, b3,..., а п нумерует орбитальные энергии (п = 1, 2, 3...). При т — 0 такая орбиталь не меняется при поворотах и наз. s-орбиталью. При m
, где т = 0, b 1, b2, b3,..., а п нумерует орбитальные энергии (п = 1, 2, 3...). При т — 0 такая орбиталь не меняется при поворотах и наз. s-орбиталью. При m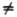 0 уровни с одинаковыми значениями
0 уровни с одинаковыми значениями 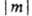 двукратно вырождены. По аналогии с АО принято обозначать МО символами
двукратно вырождены. По аналогии с АО принято обозначать МО символами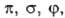 ..., если они отвечают
..., если они отвечают 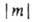 = 1, 2, 3... Аксиальносимметричные МО обозначают символами
= 1, 2, 3... Аксиальносимметричные МО обозначают символами 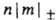 (справа внизу указывают знак т), напр. 2
(справа внизу указывают знак т), напр. 2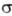 ,1
,1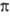 +, 2
+, 2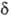 -. Как и в случае атомов, нередко используются вещественнозначные формы МО, в к-рых зависимость от j описывается простыми ф-циями декартовых координат. Соответственно возникают МО типа
-. Как и в случае атомов, нередко используются вещественнозначные формы МО, в к-рых зависимость от j описывается простыми ф-циями декартовых координат. Соответственно возникают МО типа 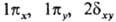 и т.д. Гомоядерная молекула имеет дополнительно центр инверсии; МО, не меняющие при инверсии знак, наз. ч е т н ы м и, а меняющие-нечетными; четность МО указывается ниж. индексами g (четная) или и (нечетная).
и т.д. Гомоядерная молекула имеет дополнительно центр инверсии; МО, не меняющие при инверсии знак, наз. ч е т н ы м и, а меняющие-нечетными; четность МО указывается ниж. индексами g (четная) или и (нечетная).
В многоатомной молекуле симметричность ядерной конфигурации отражается в том, что при повороте вокруг главной оси симметрии орбитали либо не меняются (МО типа а), либо меняют знак (МО типа b) Симметричность или антисимметричность относительно отражения в плоскости, содержащей главную ось, либо относительно поворота вокруг оси 2-го порядка, перпендикулярной главной оси симметрии, указывают ниж. индексами 1 или 2 соотв., а в случае плоскости, перпендикулярной оси,-одним или двумя штрихами. Симметрия относительно инверсии указывается ниж. индексами д и и, как и для двухатомных молекул. Напр., в молекуле с симметрией D4h орбиталь 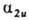 симметрична относительно поворота вокруг главной оси 4-го порядка, антисимметрична относительно поворота вокруг перпендикулярной оси 2-го порядка и относительно инверсии. Если при поворотах МО переходит в комбинацию двух (или трех) МО, как это имеет место для МО типа
симметрична относительно поворота вокруг главной оси 4-го порядка, антисимметрична относительно поворота вокруг перпендикулярной оси 2-го порядка и относительно инверсии. Если при поворотах МО переходит в комбинацию двух (или трех) МО, как это имеет место для МО типа 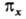 и
и 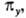 она обозначается символом "e" (или f) с соответствующими индексами (употребителен также символ t).
она обозначается символом "e" (или f) с соответствующими индексами (употребителен также символ t).
Изменение знака МО при отражении в плоскости означает, что в этой плоскости МО обращается в нуль. С ростом числа узловых плоскостей МО, вообще говоря, отвечает все более высоким значениям орбитальных энергий.
Для систем, где имеются локальные плоскости симметрии, напр. для молекул с ненасыщ. связями, МО обозначают не так, как следовало бы для группы симметрии Сg т. е. не a' или а:, а используют обозначения, аналогичные обозначениям МО двухатомных молекул: МО, симметричные относительно плоскости, обозначаются как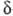 -орбитали, а антисимметричные относительно плоскости - как
-орбитали, а антисимметричные относительно плоскости - как 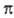 -орбитали. Поскольку
-орбитали. Поскольку 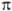 -орбитали заведомо имеют плоскость симметрии, в к-рой они обращаются в нуль, орбитальные энергии МО возрастают в ряду
-орбитали заведомо имеют плоскость симметрии, в к-рой они обращаются в нуль, орбитальные энергии МО возрастают в ряду 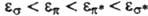 , где * означает разрыхляющую орбиталь (см. ниже). Орбитали, отвечающие неподеленной паре электронов, обозначаются как п.
, где * означает разрыхляющую орбиталь (см. ниже). Орбитали, отвечающие неподеленной паре электронов, обозначаются как п.
Под действием электромагн. поля наиб. вероятны переходы с изменением состояния лишь одного из электронов, поэтому при описании квантовых переходов в сопряженных системах принято указывать лишь символы соответствующих МО; напр., в ненасыщ. системах возможны переходы 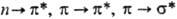 и т.п.
и т.п.
В рамках ЛКАО-приближения МО можно связать с орбиталями атомов, образующих молекулу. Если орбитальная энергия, отвечающая электрону в молекуле, ниже, чем в атоме, МО наз. связывающей, если выше-разрыхляющей. Если же орбитальная энергия при переходе от атомов к молекуле почти не изменяется, как в случае неподеленных пар электронов, МО наз. несвязывающей.
Схематически образование МО из АО часто передают корреляц. диаграммами. Правила построения кор-реляц. диаграмм состоят в том, что наиб, вклад в МО дают АО с близкими орбитальными энергиями. Кроме того, эти АО должны относиться к одному типу симметрии относительно операций симметрии молекулы. Напр., в случае диаграммы, представленной на рис. 2, АО типа 2рх в молекуле оказывается  -орбиталью, а АО типа 2р. -
-орбиталью, а АО типа 2р. -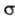 -орби-талью, т.е. АО 2рх и 2рz не должны одновременно входить в состав одной и той же МО.
-орби-талью, т.е. АО 2рх и 2рz не должны одновременно входить в состав одной и той же МО.
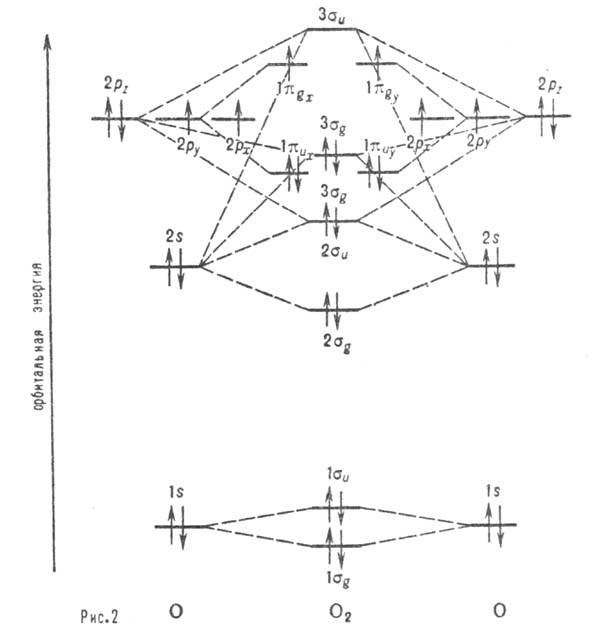
Рис. 2. Корреляц. диаграмма для молекулы О2. Горизонтальные линии отвечают энергиям атомных и мол. орбиталей. Пунктирные линии указывают, в какие мол. орбитали входят данная атомная орбиталь с большим вкладом. Орбитали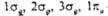 -связывающие, а
-связывающие, а 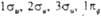 -разрыхляющие. Стрелками обозначено заполнение орбиталей в основном (низшем по энергии) состояния молекулы О2 (триплетное состояние).
-разрыхляющие. Стрелками обозначено заполнение орбиталей в основном (низшем по энергии) состояния молекулы О2 (триплетное состояние).
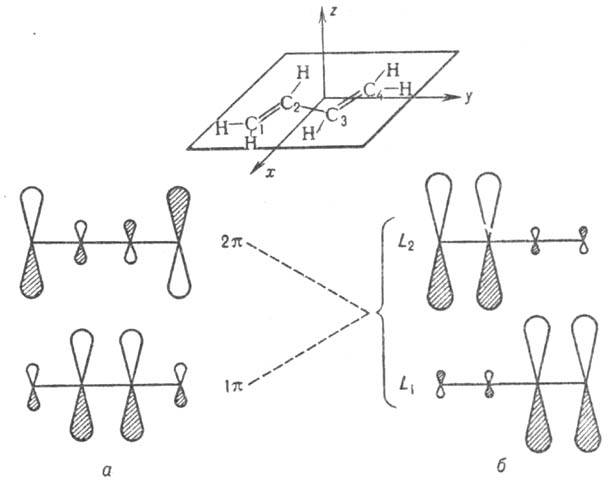
Рис. 3. Занятые p-орбитали основного состояния 1,3-бутадиена; а- 1 - и 2
- и 2 -орбитали; б-локализованные орбитали p-типа, полученные из 1
-орбитали; б-локализованные орбитали p-типа, полученные из 1 - и 2
- и 2 -орбиталей. Орбитали расположены в порядке возрастания орбитальных энергий.
-орбиталей. Орбитали расположены в порядке возрастания орбитальных энергий.
Обычно МО изображают графически, указывая систему АО 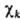 , ее образующих (рис. 3). При этом изображают контуры АО, расположенных вблизи соответствующих ядер молекулы. Размеры АО на рис. отражают величину коэф. перед ней в представлении МО , а знаки (фазы) АО учитывают знак Ck. В хим.
, ее образующих (рис. 3). При этом изображают контуры АО, расположенных вблизи соответствующих ядер молекулы. Размеры АО на рис. отражают величину коэф. перед ней в представлении МО , а знаки (фазы) АО учитывают знак Ck. В хим. 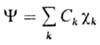 приложениях применяют несимметричные орбитали, локализованные в отдельных областях пространства и описывающие в этих областях распределение электронной плотности. Закономерности строения локализованных орбиталей в эквивалентных фрагментах разл. молекул часто связывают с предоставлением о гибридизации АО.
приложениях применяют несимметричные орбитали, локализованные в отдельных областях пространства и описывающие в этих областях распределение электронной плотности. Закономерности строения локализованных орбиталей в эквивалентных фрагментах разл. молекул часто связывают с предоставлением о гибридизации АО.
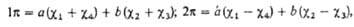
где 0 = 0,372, b = 0,602, 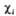 -атомная орбиталь 2pz атома Сi (i=1, 2, 3, 4). 1
-атомная орбиталь 2pz атома Сi (i=1, 2, 3, 4). 1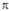 -орбиталь имеет одну узловую плоскость (ху), 2
-орбиталь имеет одну узловую плоскость (ху), 2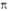 -орбиталь имеет дополнит. узловую плоскость, перпендикулярную этой плоскости и проходящую между атомами С2 и С3. Локализованные орбитали отвечают в осн. хим. связям C1—С2 (L1) и C3-C4 (L2): L1=
-орбиталь имеет дополнит. узловую плоскость, перпендикулярную этой плоскости и проходящую между атомами С2 и С3. Локализованные орбитали отвечают в осн. хим. связям C1—С2 (L1) и C3-C4 (L2): L1=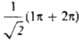 , L2 = . Напр., L1 = с(
, L2 = . Напр., L1 = с( 1 +
1 +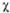 2) + d(
2) + d(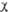 з -
з -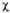 4), где d = 0,162, с = 0,689. Изолир.
4), где d = 0,162, с = 0,689. Изолир. 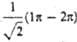 двойной связи С1=C2 отвечает орбиталь я-типа 0,707 ·(
двойной связи С1=C2 отвечает орбиталь я-типа 0,707 ·( 1 +
1 +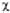 2).
2).
Базисные орбитали. Помимо рассмотренных АО и МО, имеющих ясный физ. смысл, в квантовой химии часто используют орбитали, к-рые определяют формальным образом. Таковы, в частности, базисные орбитали, линейная комбинация к-рых позволяет правильно описать АО или МО в ЛКАО-приближении. В роли базисных используют орбитали, близкие по форме к атомным орбиталям. Напр., слэйтеровские орбитали имеют вид 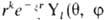 ), гауссовы орбитали-
), гауссовы орбитали-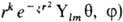 или xaybzc
или xaybzc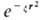 (декартовы гауссовы орбитали). Нередко в роли базисных орбиталей используют линейные комбинации неск. гауссовых орбиталей (при этом говорят о сгруппированных, или сжатых, орбиталях).
(декартовы гауссовы орбитали). Нередко в роли базисных орбиталей используют линейные комбинации неск. гауссовых орбиталей (при этом говорят о сгруппированных, или сжатых, орбиталях).
В простейших случаях базисные орбитали представляют собой АО, полностью или частично занятые в низших электронных состояниях атома. В этом случае базис орбиталей наз. одноэкспонентным минимальным. Если для описания каждой АО используют две базисные орбитали, базис наз. двухэкспонентным, и т. п. Чаще всего низшие по энергии остовные АО описываются одной базисной орбиталью, а валентные - несколькими (валентно-расщепленные базисы орбиталей). В неэмпирических методах квантовой химии используются разл. типы базисов орбиталей, за к-рыми формально сохраняется название АО.
Представление об орбиталях широко используется в химии для описания образования хим. связи и перераспределения электронной плотности при изменении строения молекул. Изменения остовных МО и соответствующих орбитальных энергий используют для интерпретации рентгеноэлектронных и фотоэлектронных спектров молекул. Высшие занятые и низшие виртуальные (незанятые) МО наиб. сильно меняются при к.-л. воздействиях на молекулу. Это позволяет использовать такие граничные МО для предсказания направления хим. р-ции. Напр., электрофильная атака наиб. вероятна в положение, отвечающее максимуму плотности низшей виртуальной МО, а нуклеофильная атака-в положение, отвечающее максимуму плотности высшей занятой МО (см. Граничных орбиталей теория). Св-ва граничных орбиталей связаны с индексами реакционной способности.
Обычно при хим. р-ции сохраняются нек-рые элементы симметрии взаимодействующих молекул; при этом сохраняется и тип симметрии МО. Это позволяет судить о том, изменяется или не изменяется электронная конфигурация многоэлектронной системы при переходе от реагентов к продуктам. Поскольку изменение электронной конфигурации приводит к появлению заметных потенц. барьеров на пути р-ции, классификация МО по их симметрии позволяет предсказать возможность протекания р-ции в заданных условиях активации (см. Вудворда-Хофмана правила).
Лит. см. при ст. Квантовая химия. В. И. Пупышев.
