Вольфрам
ВОЛЬФРАМ [от нем. Wolf - волк, Rahm - сливки ("волчья пена" - назв. дано в 16 в., т.к. мешал выплавке олова, переводя его в шлак); лат. Wolframium] W, хим. элемент VI гр. периодич. системы, ат. н. 74, ат. м. 183,85. Прир. вольфрам состоит из пяти стабильных изотопов с мас. ч. 180 (0,135%), 182 (26,41%), 183 (14,4%), 184 (30,64%) и 186 (28,41%). Поперечное сечение захвата тепловых нейтронов 19,2*10-28 м2. Конфигурация внеш. электронной оболочки 5d46s2; степени окисления +2; +3, +4, +5, +6 (наиб, характерна); энергия ионизации W° -> W+ -> W2+ соотв. 770 и 1710 кДж/моль; электроотрицательность по Полингу 1,7; сродство к электрону 0,5 эВ; работа выхода электронов 4,55 эВ; электронная эмиссия (мА/см2): 1,5*10-10 (1100 К), 2,3*10-1 (1900 К), 298 (2500 К); ат. радиус 0,1368 нм; ионные радиусы (в скобках указаны координац. числа) W4 + 0,080 нм (6), W6 + 0,065 нм (4), 0,074 нм (6).Вольфрам мало распространен в природе. Содержание в земной коре 1*10-4 % по массе. Известно ок. 15 собств. минералов, большинство из них - вольфраматы. наиб. важные минералы - вольфрамит (Fe, Mn)WO4 [его разновидности - ферберит (Fe : Mn > 4 :1) и гюбнерит (Mn : Fe > 4 :1)] и шеелит CaWO4. наиб. крупные пром. месторождения в КНР, СССР, КНДР, Южной Корее, США, Таиланде, Канаде, Боливии, Австралии, Бразилии, Португалии. Мировые запасы вольфрама в рудах 1815 тыс. т (1976).
Свойства. Вольфрам - металл светло-серого цвета. Осн. устойчивая модификация-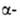 W, решетка объемноцентриров. кубическая (а = 0,31589 нм, z = 2, пространств. группа Im3m). Существует также
W, решетка объемноцентриров. кубическая (а = 0,31589 нм, z = 2, пространств. группа Im3m). Существует также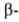 модификация с кубич. кристаллич. решеткой (z = 8, пространств. группа Рт3п); образуется при восстановлении тонкого слоя WO3 сухим Н2 при 440-630 °С; выше 630°С необратимо превращ. в
модификация с кубич. кристаллич. решеткой (z = 8, пространств. группа Рт3п); образуется при восстановлении тонкого слоя WO3 сухим Н2 при 440-630 °С; выше 630°С необратимо превращ. в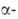 W. Вольфрам - самый тугоплавкий металл, т. пл. 3380+10 °С, т. кип. 5900-6000°С; плотн. 19,3 г/см3, жидкого 16,65 г/см3; С° 24,27 Дж/(моль*К);
W. Вольфрам - самый тугоплавкий металл, т. пл. 3380+10 °С, т. кип. 5900-6000°С; плотн. 19,3 г/см3, жидкого 16,65 г/см3; С° 24,27 Дж/(моль*К);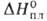 46 кДж/моль,
46 кДж/моль,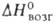 850 кДж/моль (О К); So298 32,6 Дж/(моль*К); ур-ние температурной зависимости давления пара над твердым вольфрамом в интервале 2000-3500 К: lg р (мм рт. ст.) = 42000/Г + 9,84 -— 0,146T-lg Т — 0,164*10-3T; скорость испарения [в г/(см2*с)1 2,18*10-12 (2200 К), 1,06*10-6 (3000 К), 2,06 х 10-5 (3273 К); температурный коэф. линейного расширения (К-1): 4,1*10-6 (298 К), 6,5*10-6 (2273 К), 7,1*10-6 (2673 К); теплопроводность [Вт/(м*К)]: 153 (298 К), 105 (1873 К); температуропроводность (м2/с): 3,17*103 (1873 К), 2,3*103 (2873 К); излучательная способность (Вт/см2): 23,65 (2200 К), 112,5 (2800 К), 203 (3200 К);
850 кДж/моль (О К); So298 32,6 Дж/(моль*К); ур-ние температурной зависимости давления пара над твердым вольфрамом в интервале 2000-3500 К: lg р (мм рт. ст.) = 42000/Г + 9,84 -— 0,146T-lg Т — 0,164*10-3T; скорость испарения [в г/(см2*с)1 2,18*10-12 (2200 К), 1,06*10-6 (3000 К), 2,06 х 10-5 (3273 К); температурный коэф. линейного расширения (К-1): 4,1*10-6 (298 К), 6,5*10-6 (2273 К), 7,1*10-6 (2673 К); теплопроводность [Вт/(м*К)]: 153 (298 К), 105 (1873 К); температуропроводность (м2/с): 3,17*103 (1873 К), 2,3*103 (2873 К); излучательная способность (Вт/см2): 23,65 (2200 К), 112,5 (2800 К), 203 (3200 К);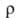 (Ом*м): 5,5*10-8 (298 К), 55,7*10-8 (2000 К), 108,5*10-8 (2500 К); температурный коэф.
(Ом*м): 5,5*10-8 (298 К), 55,7*10-8 (2000 К), 108,5*10-8 (2500 К); температурный коэф.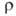 5,0*10-3 К -1 (273 - 473 К); т-ра перехода в сверхпроводящее состояние 0,0160 К. Вольфрам парамагнитен, магн. восприимчивость 0,32*10-9. Мех. св-ва вольфрама сильно зависят от способа его получения, чистоты и предшествующей мех. и термич. обработки. Техн. вольфрам хрупок при нормальной т-ре, при 200-500°С переходит в пластичное состояние; высокочистыи монокристаллич. Вольфрам пластичен вплоть до — 196 °С. Твердость по Бринеллю для спеченного штабика 2000-2300 МПа, для листа толщ. 2 мм 3500-4000 МПа; для проволоки модуль упругости 380-410 ГПа (298 К); в зависимости от диаметра
5,0*10-3 К -1 (273 - 473 К); т-ра перехода в сверхпроводящее состояние 0,0160 К. Вольфрам парамагнитен, магн. восприимчивость 0,32*10-9. Мех. св-ва вольфрама сильно зависят от способа его получения, чистоты и предшествующей мех. и термич. обработки. Техн. вольфрам хрупок при нормальной т-ре, при 200-500°С переходит в пластичное состояние; высокочистыи монокристаллич. Вольфрам пластичен вплоть до — 196 °С. Твердость по Бринеллю для спеченного штабика 2000-2300 МПа, для листа толщ. 2 мм 3500-4000 МПа; для проволоки модуль упругости 380-410 ГПа (298 К); в зависимости от диаметра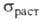 для неотожженной проволоки 1800-4150 МПа, для отожженной 900-1300 МПа. Коэф. сжимаемости вольфрама ниже, чем у всех металлов. По длительности сохранения прочности при 800-1300 °С он значительно превосходит Мо, Та и Nb. Компактный вольфрам устойчив на воздухе, при 400 °С начинает окисляться, выше 500 °С быстро окисляется до триоксида WO3 (см. Вольфрама оксиды). С холодной и горячей водой не взаимод., парами воды выше 600 °С окисляется до WO3, WO2 и др. оксидов. На холоду устойчив к действию соляной к-ты, H2SO4, HNO3, а также смеси HNO3 и H2SO4, активно взаимод. со смесью к-т HNO3 и HF, медленно - с Н2О2. При 90-100 °С устойчив к действию фтористоводородной к-ты, слабо взаимод. с соляной к-той, H2SO4 и Н2СrО4, несколько сильней - с HNO3 и царской водкой. Не взаимод. с р-рами щелочей и NH3 на холоду, слабо реагирует с ними при нагр. в присут. О2. Быстро окисляется в расплавленном NaOH или КОН при доступе воздуха или в присут. окислителей (NaNO3, NaNO2 и др.) с образованием волъфраматов.
для неотожженной проволоки 1800-4150 МПа, для отожженной 900-1300 МПа. Коэф. сжимаемости вольфрама ниже, чем у всех металлов. По длительности сохранения прочности при 800-1300 °С он значительно превосходит Мо, Та и Nb. Компактный вольфрам устойчив на воздухе, при 400 °С начинает окисляться, выше 500 °С быстро окисляется до триоксида WO3 (см. Вольфрама оксиды). С холодной и горячей водой не взаимод., парами воды выше 600 °С окисляется до WO3, WO2 и др. оксидов. На холоду устойчив к действию соляной к-ты, H2SO4, HNO3, а также смеси HNO3 и H2SO4, активно взаимод. со смесью к-т HNO3 и HF, медленно - с Н2О2. При 90-100 °С устойчив к действию фтористоводородной к-ты, слабо взаимод. с соляной к-той, H2SO4 и Н2СrО4, несколько сильней - с HNO3 и царской водкой. Не взаимод. с р-рами щелочей и NH3 на холоду, слабо реагирует с ними при нагр. в присут. О2. Быстро окисляется в расплавленном NaOH или КОН при доступе воздуха или в присут. окислителей (NaNO3, NaNO2 и др.) с образованием волъфраматов.
С азотом вольфрам реагирует выше 1500°С; при 2300-2500 °С образуется нитрид WN2, к-рый в отсутствии N2 разлагается выше 800 °С. Водород не реагирует с вольфрамом вплоть до т-ры плавления. В вольфраме мало растворимы О2 (менее 10-4% по массе), N2 (~ 10-5%) и Н2 (менее 10-4%), с F2 выше 150°С вольфрам образует фториды (см. Вольфрама гексафторид), с С12 выше 800°С - хлориды, с Вr2 и I2 при 600-700°С - соотв. бромиды и иодиды (см. Вольфрама галогениды).
С парами S и Se, а также с H2S и H2Se выше 400 °С образует соотв. дисульфид WS2 (см. Вольфрама сульфиды)и диселенид WSe2, с кремнием и бором выше 1400°С - соотв. силициды (WSi2 и W5Si3) и бориды (W2B, WB, W2B5 и др.). При 700-800 °С SO2 окисляет вольфрам до оксидов, СО2 выше 1200°С - до WO2, оксиды N выше 600°С - до WO3. Взаимод. вольфрама с углеводородами при 1100-1200 °С приводит к карбидам. До ~ 1400°С вольфрам устойчив в атмосфере СО, при более высокой т-ре образуются вольфрама карбиды. При 200-300 °С и давлении СО 20 МПа вольфрам (в возбужденном состоянии) образует с СО гексакарбонил W (СО)6 - бесцв. кристаллы; т. пл. 169°С, т. кип. 175°С; не раств. в воде; выше 350°С разлагается на W и СО; применяют как катализатор полимеризации олефинов, для нанесения вольфрамовых покрытий на металлы, керамику, графит, для синтеза воль-фраморг. соед. (см. также Карбонилы металлов).
Вольфрам очень медленно взаимод. с Hg, Na, К, Ga, Mg даже при 600 °С. Он устойчив при 600 °С в сплаве Вуда (см. Свинца сплавы), при 1000°С - в эвтектич. сплаве Na-K, до 1680°С не реагирует с расплавленными Bi, Ca, Си и Sn. При 1100oС вольфрам медленно раств. в U, выше 700 °С реагирует с жидким А1, давая интерметаллиды. Вольфрам способен образовывать сплавы со мн. металлами (см. Вольфрама сплавы).
Важнейшие кислородные соед. вольфрама - WO3, вольфрамовая к-та WO3*Н2О и ее соли (вольфраматы). Известны поливольфраматы - соли высокомол. изополи- и акваполикислот, а также гетерополивольфраматы - соли гетерополивольфрамовых к-т (см. Гетерополисоединения). При восстановлении вольфраматов щелочных металлов получают вольфрамовые бронзы-кристаллич. в-ва с металлич. св-вами (см. Бронзы оксидные).
Диселенид вольфрама WSe2 - темно-серые кристаллы с гексагон. решеткой (а = 0,3280 нм, с=1,2950нм, пространств. группа p63/mmc); выше 550 °С окисляется на воздухе до WO3; в вакууме выше 900 °С диссоциирует на W и Se. Не раств. в воде; не взаимод. с разб. НС1, H2SO4, р-рами щелочей. Окисляется HNO3. Получают взаимод. паров Se или H2Se с W или WO3 при 600-800 °С. Полупроводник р-типа; используется как твердая смазка.
Дисилицид вольфрама WSi2 - голубовато-серые кристаллы с тетрагон. решеткой (а = 0,3212 нм, с = = 0,7880 нм, z = 2, пространств. ггруппа I4/mmm); т. пл. 2165 °С; плотн. 9,25 г/см3;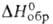 - 93,7 кДж/моль;
- 93,7 кДж/моль;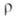 12,5*10-8 Ом*м;
12,5*10-8 Ом*м;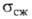 1269 МПа (20°С); микротвердость 10740 МПа (нагрузка 50 г). Не раств. в воде; не взаимод. с неорг. к-тами (кроме фтористоводородной к-ты). Получают: взаимод. паров Si с W в вакууме при 1150-1350 °С; восстановлением SiCl4 водородом на нагретой до 1100-1800°С пов-сти W; по р-ции 4SiCl2 + + W
1269 МПа (20°С); микротвердость 10740 МПа (нагрузка 50 г). Не раств. в воде; не взаимод. с неорг. к-тами (кроме фтористоводородной к-ты). Получают: взаимод. паров Si с W в вакууме при 1150-1350 °С; восстановлением SiCl4 водородом на нагретой до 1100-1800°С пов-сти W; по р-ции 4SiCl2 + + W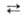 WSi2 + 2SiCl4. Образует на изделиях из вольфрама защитные покрытия, устойчивые на воздухе до 2000 °С.
WSi2 + 2SiCl4. Образует на изделиях из вольфрама защитные покрытия, устойчивые на воздухе до 2000 °С.
Борид вольфрама (пентаборид дивольфрама) W2B5 - серые кристаллы с металлич. блеском, решетка гексагональная (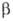 =W2B5; а = 0,292нм, с=1,387нм, пространств, группа С6/mmc); т. пл. 2300 °С (с разл.); плотн. 13,0 г/см3; микротвердость 25800 МПа; на воздухе выше 800°С окисляется. Не раств. в воде. Разлагается царской водкой, а также HNO3 и конц. H2SO4 при кипячении. Получают взаимод. WO3 с В4С и С в вакууме при 1150-1300 °С. Компонент твердых сплавов для режущих инструментов, наплавочных износостойких материалов для стали и чугуна; образует защитные покрытия на вольфраме.
=W2B5; а = 0,292нм, с=1,387нм, пространств, группа С6/mmc); т. пл. 2300 °С (с разл.); плотн. 13,0 г/см3; микротвердость 25800 МПа; на воздухе выше 800°С окисляется. Не раств. в воде. Разлагается царской водкой, а также HNO3 и конц. H2SO4 при кипячении. Получают взаимод. WO3 с В4С и С в вакууме при 1150-1300 °С. Компонент твердых сплавов для режущих инструментов, наплавочных износостойких материалов для стали и чугуна; образует защитные покрытия на вольфраме.
Получение. Вольфрамовые руды (содержат 0,15-0,5% WO3) обогащают гравитационными методами, флотацией, магн. и электростатич. сепарацией, а также хим. способами. Для получения вольфрама и его соед. используют рудные концентраты, содержащие 55-65% WO3, иногда 10-20%, направляемые на хим. переработку. Пром. способы извлечения вольфрама из рудных концентратов подразделяют на щелочные (наиб. распространенные) и кислотные. В первом случае вольфрамитовый или шеелитовый концентрат разлагают спеканием с Na2CO3 при 800-900 °С с послед. выщелачиванием спека водой или обработкой р-ром Na2CO3 в автоклаве при 200-225 °С Вольфрамитовые концентраты иногда разлагают нагреванием с р-рами NaOH. Для полного разложения вольфрамита спеканием требуется небольшой избыток Na2CO3 по сравнению со стехиометрически необходимым кол-вом; в случае шеелита в шихту добавляют SiO2 (2CaWO4 + 2Na2CO3 + SiO2 -> 2Na2WO4 + + Ca2SiO4 + 2CO2). Для полного разложения в автоклаве шеелитовых концентратов избыток Na2CO3 должен составлять 250-300%, а в случае вольфрамитовых концентратов - 300-400%. Из образовавшихся водных р-ров Na2WO4 после их очистки от примесей (Si, P, As, Mo, F) действием СаС12 или Ca(NO3)2 осаждают CaWO4, к-рый затем разлагают соляной к-той или HNO3 и выделяют вольфрамовую к-ту. Последнюю прокаливают, получая WO3, или растворяют в водном р-ре NH3, из к-рого выпариванием кристаллизуют паравольфрамат (NH4)10[H2W12O42]*4Н2О. Это соед. м. б. также получено более простым способом - экстракцией водными р-рами солей аминов или четвертичных аммониевых соед. (при рН 2,5-3) с послед. реэкстракцией р-рами NH3. Перспективен метод его получения из р-ров Na2WO4 с использованием ионообменных смол.
По кислотному способу шеелитовые концентраты (с содержанием WO3 65-75%) разлагают к-тами (НС1, HNO3); образующуюся при этом вольфрамовую к-ту раств. в водном р-ре NH3 и затем кристаллизуют в виде паравольфрамата аммония.
Осн. продукты переработки вольфрамовых концентратов - WO3 (получаемый термич. разложением W03-H20 или (NH4)10[H2W12042]*4H20) и ферровольфрам [сплав W (65-80%) и Fe (35-20%), выплавляемый для нужд черной металлургии]. Восстановлением WO3 водородом при 700-900 °С в многотрубных или вращающихся трубчатых печах получают вольфрам в виде порошка разл. гранулометрич. состава (наиб, типичны порошки со средним размером частиц 2-3 мкм). Осн. примесь в порошках - кислород (0,05-0,3%). Получают также порошки вольфрама с присадками оксидов Th, La, Y, A1, а также K2SiO3, к-рые вводят в WO3 перед его восстановлением.
Компактный металл получают преим. методами порошковой металлургии. Заготовки сечением от 10*10 до 20*20 мм и длиной 500-600 мм (штабики) прессуют под давл. 150-500 МПа и подвергают спеканию в две стадии: первая (упрочнение штабика) проводится при 1150-1300 °С в атмосфере Н2, вторая (сварка)-прямым пропусканием электрич. тока при 2900-3000 °С. Плотность штабиков после спекания 17,5-18,5 г/см3. Изделия из них (проволока, лента и др.) изготовляют обработкой давлением при т-рах ниже т-ры рекристаллизации вольфрама. По мере обработки т-ра понижается от 1300-1400 °С (при ковке) до 800-500 °С (при волочении или прокатке). В результате волочения через твердосплавные, а затем алмазные фильеры получают вольфрамовую проволоку диаметром 10-300 мкм.
Крупные заготовки (до 300 кг) производят методом гид-ростатич. прессования порошков, помещенных в эластичные оболочки. Такие заготовки спекают в индукционных печах в вакууме или в атмосфере Н2 при 2400-2500 °С. Для получения компактных заготовок используют также дуговую вакуумную плавку или гарнисажную дуговую с разливом металла в изложницу.
В огранич. масштабах вольфрам получают восстановлением его гексагалогенидов, гл. обр. WF6, водородом. При проведении процесса в газовой фазе в потоке получают высокодисперсные порошки, в кипящем слое - крупные сферич. гранулы размером 200-500 мкм. Последние превращают в компактные заготовки горячим газостатич. прессованием. Способ получения изделий восстановлением WF6 (получивший название газофазное формование) заключается в осаждении вольфрама из газовой фазы в виде плотного покрытия на нагретых до 600-700 °С подложках из др. металлов или графита. Методом бестигельной зонной плавки спеченных штабиков получают монокристаллы вольфрама, отличающиеся высокой чистотой и пластичностью.
Определение. Качественно вольфрам определяют: по выделению белого аморфного осадка WO3*nH2O при добавлении НС1 или H2SO4 в р-р образца; по образованию вольфрамовой сини при добавлении SnCl2 в кислый р-р образца; по желто-зеленой окраске р-ра в присут. роданид-иона и восстановителя (напр., SnCl2) и др. методами. При большом содержании в анализируемом образце (концентраты, ферровольфрам и др.) вольфрам определяют гравиметрически в виде WO3 (образуется после прокаливания вольфрамовой к-ты или осадков, выделяющихся при действии, напр., цинхонина, бензндина и др.), а также потенциометрич. титрованием солью Cr+ в кислой среде. При низком содержании вольфрам определяют преим. фотометрически по р-ции с роданид-ионами в присут. TiCl3. Для перевода вольфрама в р-р исходную навеску разлагают соляной или азотной к-той, осадок WO3*nH2O раств. в водном р-ре NH3; иногда используют выщелачивание содового плава водой.
Применение. До 50% получаемого вольфрама используют в произ-ве легированных (гл. обр. инструментальных) сталей, важнейшие из к-рых - быстрорежущие, содержащие 8-20% вольфрама. Примерно 35-45% вольфрама расходуется на производство твердых сплавов на основе карбида WC (85-95% WC и 5-15% Со). Нек-рые сплавы, кроме WC, содержат TiC, ТаС и NbC. Эти сплавы применяют для изготовления рабочих частей режущих и буровых инструментов, фильер для протяжки проволоки и др. В виде сплавов с др. металлами вольфрам используют в авиац. и ракетной технике, электротехнике; чистый вольфрам - для изготовления спиралей и нитей накаливания в произ-ве электроламп, в электровакуумной технике для изготовления катодов, рентгеновских трубок, сеток, подогревателей катодов, выпрямителей высокого напряжения и др.
Искусственные радиоактивные изотопы вольфрама 181W (T1/2 120сут), 185W (T1/2 78,5 сут) и 187W (T1/2 24 ч) - изотопные индикаторы.
Произ-во вольфрамовых концентратов (65% WO3) в капиталистич. странах 39400 т/год (1978), в т.ч. в США 6300, Таиланде 6200, Боливии 6100, Южной Корее 5000, Австралии 5300, Канаде 4400, Бразилии 2200, Португалии 2100 т/год.
Вольфрам открыт в виде WO3 К. Шееле в 1781. Металлич. вольфрам впервые получили X. X. и Ф. д'Элуяры в 1873. В Великобритании, США и Франции употребляется первоначальное название вольфрама - "тангстен" (тунгстен, швед. tungsten, букв. - тяжелый камень).
Литература
Зеликман А. Н., Крейн О. Е., Самсонов Г. В., Металлургия редких металлов, 3 изд., М., 1978; Зеликман А. Н., Никитина Л. С, Вольфрам, М., 1978; Rollinson С. Pergamon textes in inorganic chemistry, v. 21-The chemistry of Cr, Mo and W, Oxf.-[a.o.]. 1973; YihS.W.H., WangC.T., Tungsten, N. Y., 1978; Gmelins Handbuch der anorganischen Chemie. Wolfram, Bd A. 1, Technologic des Metals, В., 1979. А. Н. Зеликман.
