Азот
АЗОТ (от греч. а--приставка, здесь означающая отсутствие, и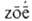 -жизнь; лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу) N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир. азот состоит из двух стабильных изотопов- 14N (99,635%) и 15N (0,365%). Конфигурация внеш. электронной оболочки 2s22p3; степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070, 667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный 0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац. числа) для N3- 0,132 нм (4), для N3 + 0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6).
-жизнь; лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу) N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир. азот состоит из двух стабильных изотопов- 14N (99,635%) и 15N (0,365%). Конфигурация внеш. электронной оболочки 2s22p3; степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070, 667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный 0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац. числа) для N3- 0,132 нм (4), для N3 + 0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6).
Молекула азота двухатомна, связь между атомами тройная (длина 0,110 нм). Энергия термич. диссоциации молекулы велика (941,64 кДж/моль), поэтому диссоциация становится заметной лишь при очень высоких т-рах. Так, при 3000°С и нормальном давлении диссоциирована лишь 0,1% молекул.
Общее содержание азота в земной коре 1*10-2 % по массе. Наиб. часть азота находится в своб. состоянии в атмосфере (азот - главная составная часть воздуха: 75,6% по массе или 78,09% по объему). В связанном состоянии азот встречается в воздухе, в водах рек, морей и океанов. В земной коре он образует три осн. типа минералов, содержащих ионы CN-, NO3- и NH+4. Пром. значение имеет натриевая (чилийская) селитра NaNO3, крупные залежи к-рой находятся в Чили; в сравнительно больших кол-вах встречается калиевая (индийская) селитра KNO3. В виде нейтральных и ионизир. атомов, а также в виде соед. [NO, (CN)2, NH3] азот обнаружен в составе газовых облаков комет, в туманностях и в атмосфере Солнца.
Азот входит в состав всех живых организмов. В небольших кол-вах содержится в каменном угле (1,0-2,5%) и нефти (0,2-1,7%). Велико значение азота в жизнедеятельности растений и животных: в белках его до 17%, в организме человека в целом ок. 3%.
Азот участвует в круговороте в-в в природе. Значит. его кол-во поступает в почву в результате жизнедеятельности азотфиксирующих бактерий, способных переводить своб. азот в соединения (см. Азотфиксация), а также в результате нек-рых др. природных процессов. Проблема связывания атм. азота была решена в нач. 20 в. с освоением пром. синтеза NH3 из N2 воздуха и Н2.
Азот - бесцв. газ; т. кип. - 195,80°С, т. пл. -210,00°С; плотн. 1,25046 кг/м3 (0°С), жидкого-0,808 г/см3 (-195,80°С); тройная точка: т-ра -210,00°С, давл. 125,03 гПа; tкрит-146,95°С, ркрит 3,9 МПа, dкрит 0,304 г/см3; уравнение температурной зависимости давления пара: lgp(MM рт.ст.) = 7,65894-359,093/7 (52-483 К); для газа С0p 29,125 ДжДмоль*К), S°298191,498 Дж/(моль*К); теплопроводность 0,077 (82 К), 0,243 (273 К), 0,315 (373 К), 0,725 ВтДм * К) (1273 К);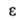 1,000 (298 К), 1,445 (75 К). Для жидкого азота в контакте с воздухом
1,000 (298 К), 1,445 (75 К). Для жидкого азота в контакте с воздухом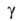 8,5 Н/см (-196,15 °С).
8,5 Н/см (-196,15 °С).
В твердом состоянии при обычном давлении азот существует в двух модификациях: ниже — 237,54°С устойчива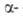 форма с кубич. решеткой типа СО (а = 0,5667 нм, пространств. группа Р213; плотн. 1,0265 г/см3 при - 252,50°С), выше — 237,54 °С-
форма с кубич. решеткой типа СО (а = 0,5667 нм, пространств. группа Р213; плотн. 1,0265 г/см3 при - 252,50°С), выше — 237,54 °С-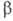 -форма с гексаген, решеткой типа MgO (а = 0,393нм, с = 0,650нм, пространств, группа Р63/ттс; плотн. 0,8792 г/см3 при -210,00°С);
-форма с гексаген, решеткой типа MgO (а = 0,393нм, с = 0,650нм, пространств, группа Р63/ттс; плотн. 0,8792 г/см3 при -210,00°С); Н° перехода 0,231 кДж/моль. Выше 350 МПа существует третья модификация с тетрагон. кристаллич. решеткой.
Н° перехода 0,231 кДж/моль. Выше 350 МПа существует третья модификация с тетрагон. кристаллич. решеткой.
Р-римость азота в воде (см3 в 100 мл): 2,33 (0°С), 1,42 (40°С), 1,32 (60°С). В нек-рых углеводородах (гексане, гептане и др.) азот растворяется лучше, чем в воде. Растворимость в этаноле и метаноле при 0°С примерно такая же, как в воде.
Большая энергия диссоциации молекулярного азота - причина исключительно малой его реакц. способности. Лишь с нек-рыми активными металлами (напр., с Li, Cs) азот реагирует при невысоких т-рах. С большинством др. простых в-в азот если и реагирует, то лишь при высокой т-ре, а иногда только при участии катализаторов.
Молекулярный азот может быть активирован соед. переходных металлов и затем превращен при обычных т-ре и давлении в NH3, гидразин или ароматич. амины. Наиб. активны в этих р-циях соед. Ti, V, Cr, Mo, Fe; восстановителями служат литий-, магний- или алюминийорг. соед., гидриды металлов, щелочные металлы, их аддукты с ароматич. углеводородами и др. Процесс проводят в апротонных средах (эфирах или углеводородах), при этом нек-рые системы [напр., (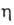 5-C5H5)2TiCl2-RMgHal] так активны, что поглощают азот с высокими скоростями даже при т-рах от — 100 до — 80 °С. При использовании в кач-ве катализаторов гидроксидов Ti(III) и Сг(П), амальгамы Na и соед. Мо азот удается восстановить в протонных средах (водно-мета-нольные р-ры щелочи).
5-C5H5)2TiCl2-RMgHal] так активны, что поглощают азот с высокими скоростями даже при т-рах от — 100 до — 80 °С. При использовании в кач-ве катализаторов гидроксидов Ti(III) и Сг(П), амальгамы Na и соед. Мо азот удается восстановить в протонных средах (водно-мета-нольные р-ры щелочи).
Ключевая стадия всех этих р-ций - связывание азота в комплекс с соед. переходного металла, при к-ром активируется молекула N2. Известны комплексы, в к-рых с одним атомом металла координированы одна, две или три молекулы N2, напр. [СоН(N2){(С6Н5)3Р}3] цис-[Mo(N2)2{(CH3)2C6H5P}4], [Mo(N2)3{(C3H7)2C6H5P}3], а также биядерные комплексы, напр.
[{(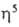 -C5H5)2Ti(C6H5)2}2N2], [{Ru(NH3)5}2N2][BF4]4,
-C5H5)2Ti(C6H5)2}2N2], [{Ru(NH3)5}2N2][BF4]4,
в к-рых азотный лиганд служит мостиком между двумя атомами металла. В большинстве этих комплексов группы М—N=N и М—N=N—M линейны.
С кислородом азот заметно взаимод. только выше 2000 °С с образованием NO, к-рый легко окисляется далее до NO2 (см. Азота оксиды). При действии ионизирующих излучений на смеси N2 с О2 образуются оксиды азота, а в присут. воды-НNО3. О кислородных соед. азота см., напр., Азотистая кислота, Азотная кислота, Азотноватистая кислота, Нитраты неорганические.
С водородом азот реагирует лишь при высоких т-ре и давлении в присут. катализатора с образованием аммиака. Косвенными путями получены гидразин N2H4 и азотисто-водородная к-та HN3, образующая соли-азиды. Ниже -15°С существует тетразен H2NN=NNH2.
С галогенами азот непосредственно не реагирует. Однако косвенными путями можно получить соед. со связями N—Hal: галогенамины NHal3, NHHal2, NH2Hal и др., трифтораминоксид NOF3, нитрозилгалогениды NOHal, ни-трилгалогениды NO2Hal, галогеназиды N3Hal и др. Наиб. устойчивы NF3, NOF и NO2F (см. Азота фториды). Трихлорид азота (трихлорамин) NC13-ярко-желтая маслянистая жидкость; т. пл. -27°С, т. кип. 71 °С; d4201,653;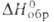 229 кДж/моль; взрывчат; раств. в бензоле, CS2, СС14, СНС13; получают взаимод. С12 с р-рами NH3 или NH4C1. Нитрози л хлорид NOC1-красно-оранжевый газ:т. пл. -59,6°С,т. кип. -6°С;плотн. 1,592 г/см3(-6°С);
229 кДж/моль; взрывчат; раств. в бензоле, CS2, СС14, СНС13; получают взаимод. С12 с р-рами NH3 или NH4C1. Нитрози л хлорид NOC1-красно-оранжевый газ:т. пл. -59,6°С,т. кип. -6°С;плотн. 1,592 г/см3(-6°С);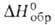 52,5 кДж/моль; заметно диссоциирует на NO и С12 уже при ~20°С; с H2SO4 образует нитрозилсерную к-ту (NO)HSO4; является одним из компонентов царской водки. Получают его взаимод. HNO3 или NO2 с NaCl при нагр., а также р-цией NO с С12 при 40-50 °С в присут. А12О3. Используют как окислитель, хлорирующий и нитрующий агент, катализатор в орг. синтезе. Фторазид N3F-зеленовато-желтый газ, т. пл. — 154°С, т. кип. -82°С; хлоразид N3Cl-бесцв. газ, т. пл. - 100°С, т. кип. — 15°С; бромазид N3Вr-красная жидкость, т. пл. -45°С; иодазид N3I-желтые кристаллы.
52,5 кДж/моль; заметно диссоциирует на NO и С12 уже при ~20°С; с H2SO4 образует нитрозилсерную к-ту (NO)HSO4; является одним из компонентов царской водки. Получают его взаимод. HNO3 или NO2 с NaCl при нагр., а также р-цией NO с С12 при 40-50 °С в присут. А12О3. Используют как окислитель, хлорирующий и нитрующий агент, катализатор в орг. синтезе. Фторазид N3F-зеленовато-желтый газ, т. пл. — 154°С, т. кип. -82°С; хлоразид N3Cl-бесцв. газ, т. пл. - 100°С, т. кип. — 15°С; бромазид N3Вr-красная жидкость, т. пл. -45°С; иодазид N3I-желтые кристаллы.
С серой азот непосредственно не реагирует. Косвенными методами получены нитриды серы: N4S4- оранжево-желтые кристаллы, которые выше температуры плавления (179°С) или при ударе разлагаются со взрывом; весьма неустойчивый N5S5-красная жидкость; (SN)X, S2N2, S4N2, S5N6 и др.
При действии азота на раскаленный угольный кокс образуется дициан (CN)2. С металлами азот дает нитриды. При высокой т-ре азот взаимод. с Si, а также с Са, Sr, Ba, Ti, W, V, Сг, Mn, Zr, Та, Mo, U, РЗЭ. Азот с СаС2 образует при высокой т-ре CaCN,. Нагревая смесь соды с углем на воздухе, получают NaCN. При 1500°С азот взаимод. с ацетиленом, давая HCN.
Азот входит в состав многочисл. орг. соед.-аминов, аминокислот, нитратов и др.
При действии электрич. разряда на молекулярный азот при давл. 130-260 Па может образоваться активный азот - смесь возбужденных молекул и атомов азота. Он образуется также при взрыве смеси О2 и СО в присут. азота, электрич. разряде в воздухе. Активный азот энергично взаимод. при комнатной температуре с атомарными кислородом и водородом, парами серы, белым фосфором и некоторыми металлами.
Азот в лаборатории м. б. получен по р-циям: NH4NO2 -> N2 + 2Н2О (практически пользуются смесью р-ров NH4C1 и NaNO2); (NH4).Cr2O7 ->N2 + Cr2O3 + 4Н2О. Наиб. чистый азот получают термич. разложением NaN3. В пром-сти азот извлекают из воздуха (см. Воздуха разделение).
В неорг. соединениях азот в форме NH4 обнаруживают по желтому окрашиванию с Несслера реактивом и др. методами; в форме NO3 - пo синему окрашиванию с дифениламином, красному окрашиванию с бруцином и др.; в форме NO-2 -по красному окрашиванию реактива Грисса (р-р сульфаниловой к-ты и а-нафтиламина в разб. уксусной к-те).
Количественно азот определяют ионизационными методами, методом изотопного разбавления (см. Газовый анализ). Азот также определяют, связывая его Li, Mg, Са или др. металлом либо окисляя кислородом в искровом разряде или в электрич. дуге с послед. поглощением образовавшегося NO2 р-ром щелочи. В форме NO-3 азот определяют гравиметрически с использованием в кач-ве осадителя нитрона, фотометрически с применением 2,4-фенолдисульфокислоты в конц. H2SO4 либо восстановлением цинком до NH3 с послед, его отгонкой в определенный объем р-ра к-ты. В форме NO2 азот определяют перманганатометрически или гравиметрически по кол-ву AgBr, а также фотометрически с реактивом Грисса; в форме нитридов-по кол-ву NH3, образовавшегося после растворения образца; в форме оксидов-по изменению объема газовой смеси после восстановления либо титриметрически после растворения в соответствующем жидком поглотителе.
Об определении азота в орг. соединениях см. Ван С лайка метод, Дюма метод, Къельдаля метод, Прегля методы, Шёнигера методы.
Осн. область использования азота - синтез NH3. Своб. азот применяют как инертную среду при нек-рых хим. и металлургич. процессах, в овощехранилищах, при перекачивании горючих жидкостей. Жидкий азот - хладагент (в криостатах, вакуумных установках и др.).
Газообразный азот хранят в баллонах черного цвета с желтой надписью "азот", подчеркнутой коричневой полосой, жидкий азот - в сосудах Дьюара, также черного цвета.
Мировое произ-во азота ок. 72 млн. т/год (1978).
Азот открыт Д. Резерфордом в 1772.
Литература
Шилов А. Е., "Успехи химии", 1974, т. 43, а 5, с. 863-902; Жаворонков Н. М., "Ж. Всес. хим. об-ва им. Д.И. Менделеева", 1978, т. 23, в. 1, с. 9-22; Проблемы фиксации азота. Неорганическая и физическая химия. Биохимия, пер. с англ., М., 1982; Новое в химической фиксации азота, пер. с англ., М., 1983; Jones К, The chemistry of nitrogen, Oxf., 1975 (Pergamon texts in inorganic chemistry, v. II). Н. М. Жаворонков.
