Растворимость
РАСТВОРИМОСТЬ, способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов (см. Растворы). Обычно растворителем считают в-во, к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии, р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Растворимость определяется физ. и хим. сродством молекул р-рителя и растворяемого в-ва, соотношением энергий взаимод. однородных и разнородных компонентов р-ра. Как правило, хорошо раств. друг в друге подобные по физ. и хим. св-вам в-ва (эмпирич. правило "подобное раств. в подобном"). В частности, в-ва, состоящие из полярных молекул, и в-ва с ионным типом связи хорошо раств. в полярных р-рителях (воде, этаноле, жидком аммиаке), а неполярные в-ва хорошо раств. в неполярных р-рителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная растворимость неэлектролитов возрастает с уменьшением разности их параметров растворимости d=(Е/V)1/2, где Е-теплота испарения, V-полярный объем. Параметр р-римости - одно из осн. понятий, определяющих когезион-ные св-ва в-в в конденсир. состояниях; важная технол. характеристика полимеров и р-рителей, лакокрасочных материалов и т.п. (см. Когезия). Растворимость мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости р-рителя. Обычно более растворимы электролиты с большей склонностью к сольватации р-рителем; образование кристаллогидратов обычно увеличивает растворимость солей.
Растворимость данного в-ва зависит от т-ры и давления соотв. общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип). Концентрация насыщ. р-ра при данных условиях численно определяет растворимость в-ва в данном р-рителе и также наз. растворимостью. Пересыщенные р-ры содержат большее кол-во растворенного в-ва, чем это соответствует его растворимости, существование пересыщенных р-ров обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы). Для характеристики растворимости малорастворимых в-в используют произведение активностей ПА (для р-ров, близких по своим св-вам к идеальному,-произведение р-римости ПР).
Растворение газов в воде-экзотермич. процесс, поэтому с ростом т-ры растворимость газов в воде уменьшается. В орг. р-рителях газы часто раств. с поглощением тепла и с ростом т-ры растворимость газов повышается. В нек-рых случаях на кривых зависимости р-римости газов от т-ры наблюдается минимум (напр., система водород-вода). При постоянной т-ре в случае образования идеального разб. бинарного р-ра неэлектролита растворимость газа (молярная доля в р-ре) пропорциональна его парциальному давлению над р-ром (см. Генри закон). С ростом давления для определения растворимости газа необходимо учитывать отклонение его св-в от св-в идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость - жидкость (жидкие смеси) различаются по след. типам: жидкости смешиваются друг с другом во всех отношениях (напр., система вода - этанол); жидкости практически нерастворимы друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый эфир). С ростом т-ры взаимная растворимость жидкостей в большинстве случаев увеличивается и, если не достигается т-ра кипения, существует т-ра, при к-рой обе жидкости смешиваются друг с другом в любых соотношениях,-т. наз. критич. т-ра р-римости, или верх. критич. точка смешения (ВКТС). Если достигается т-ра кипения, осуществляется трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика или паровая перитектика. В нек-рых системах взаимная растворимость повышается с понижением т-ры и возможно достижение ниж. критич. т-ры смешения (HKTС). Известны системы (напр., вода-трибу-тилфосфиноксид), где имеется и верхняя и нижняя критич. точки (см. Критическое состояние). Обычно область расслаивания жидкой смеси при понижении т-ры пересекается с линией ликвидуса с образованием монотектич. или синтек-тич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на растворимость зависит от того, как изменяется с давлением молярный объем в-ва и его парциальный молярный объем в р-ре. Если при нек-ром давлении молярный объем в-ва становится меньше его парциального молярного объема, растворимость в-ва с ростом давления снижается. Такая закономерность характерна для неполярных р-рителей; напр., растворимость гексахлорэтана в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при высоких давлениях на кривой зависимости растворимости от давления имеется максимум. Для электролитов на зависимости растворимости от давления сказывается изменение молярного объема вследствие сольватации ионов молекулами р-рителя. Взаимная растворимость жидкостей мало зависит от давления, зависимость становится заметной при давлениях порядка неск. ГПа.
В-во, способное раств. в двух неограниченно смешивающихся друг с другом р-рителях, распределяется между ними так, что отношение его активностей в этих р-рителях а1 и а2 при постоянной т-ре остается постоянным, независимо от общего кол-ва растворенного в-ва: a1/a2 = К, где К - коэф. распределения (закон Бертло-Нернста). Для сильно разб. р-ров вместо отношения активностей компонентов можно записать отношение их концентраций.
Растворение твердых тел в жидкостях может сопровождаться поглощением тепла, в этом случае повышение т-ры приводит к увеличению растворимости. Если образуется идеальный р-р, зависимость растворимости от т-ры записывается ур-нием Шредера
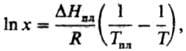
где DHпл и Тпл -энтальпияплавления и -т-ра плавления растворенного в-ва. Если энергия сольватации больше энергии, необходимой для разрушения кристаллич. решетки, растворение является экзотермич. процессом и растворимость с ростом т-ры понижается. У нек-рых в-в (напр., гипс) наблюдается минимум на кривой зависимости растворимости от т-ры. При образовании твердых растворов максимум растворимости достигается, как правило, при т-ре трехфазного равновесия - эвтектического или перитектического. Но в нек-рых системах максимум растворимости отвечает более высокой т-ре (системы с ретроградной растворимостью).
Растворимость изучают изотермич. или политермич. методами (см. Термический анализ). Полученные результаты представляют в виде диаграмм растворимости, к-рые являются частным случаем диаграммы состояния. Объемное изображение фазовых состояний системы в пространстве параметров состояния (т-ры и составов разл. фаз) сводят спец. приемами к фигурам на плоскости. Для тройной системы из двух солей и воды используют обычный концентрац. треугольник, вершины к-рого отвечают чистым компонентам (см. Многокомпонентные системы). Применяют также изображение растворимости по способу Шрейнемакерса (Ф. Схрейнемакерс), при к-ром вершина прямоугольной системы координат отвечает чистой воде, а по обеим осям откладывают концентрации солей, выраженные кол-вом той или другой соли на определенное кол-во воды (1 моль). Точки, отвечающие чистым солям, лежат в бесконечности (см. рис. а). Др. прием построения диаграмм растворимости на плоскости - способ Йенеке (см. рис. б): на оси абсцисс отражается состав солевой массы р-ра, т.е. соотношение концентраций солей, а по оси ординат откладывается кол-во воды на определенное кол-во растворенных в-в (напр., 1 моль). В этом способе в бесконечности находится точка, отвечающая чистой воде. На диаграммах (см. рис. а и б) буквой Ж обозначено фазовое поле гомог. системы (р-ра), Ж+А и Ж+В- фазовые поля пересыщенных р-ров, Ж + А + В - тройная пересыщенная система; линии А'E отвечают р-рам, насыщ. компонентом А (концентрация насыщения при данном содержании В), линии ЕB'-р-рам, насыщенным компонентом В, Е-эвто-нич. точка системы (эвтоника), отвечающая составу р-ра, насыщенного двумя компонентами (аналог эвтектики на диаграммах плавкости). Точка эвтоники характеризуется макс. концентрацией растворенных в-в в р-ре, миним. парциальным давлением пара р-рителя над р-ром, постоянством состава р-ра и давления пара при изотермич. испарении вплоть до окончат. высыхания системы.
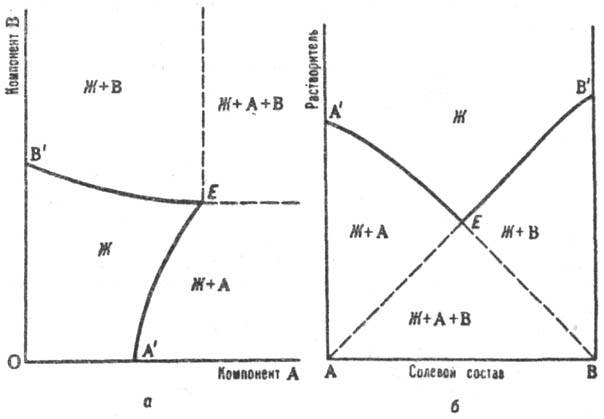
Изотермич. диаграмма р-римости тройной системы соль А - соль В - вода с изображением по способу Шрейнемакерса (а) и по способу Йенеке (б). Пояснения в тексте.
Использование диаграмм растворимости позволяет установить сосуществующие фазы при данной т-ре и соответствующие им составы р-ров, провести расчеты процессов испарения, кристаллизации из р-ров и т. п., что необходимо для обоснования многих технол. схем. Напр., диаграмма растворимости системы KCl-NaCl-H2O является основой технологии переработки сильвинитов, системы K2SO4-MgCl2-H2O-переработки полиминеральных галургич. руд.
Лит.: Новоселова А. В., Методы исследования гетерогенных равновесий, М., 1980; Ксензенко В. И., Кононова Г. Н., Теоретические основы переработки галургического сырья, М., 1982. П. И. Федоров.
