Сольватация
СОЛЬВАТАЦИЯ, взаимод. молекул растворенного в-ва (или их ассоциатов) с молекулами р-рителя. Приводит к изменению св-в молекул в р-ре (в сравнении со св-вами газовой фазы), влияет на все физ. и физ.-хим. процессы, протекающие в р-рах, в т.ч. определяет скорость реакций в растворах и положение равновесия, а в ряде случаев и их механизм. Сольватация в водных средах часто наз. гидратацией. Наиб. интенсивна сольватация ионов в растворах электролитов.
Сольватация состоит в том, что молекула растворенного в-ва оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул р-рителя. В результате сольватации образуются сольваты-мол. образования постоянного или переменного состава. Время жизни соль-ватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимод. время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В соответствии с типами межмол. взаимод. выделяют неспецифическую и специфическую сольватацию. Неспецифическая сольватация обусловлена ван-дер-ваальсовыми взаимод., специфическая сольватация проявляется гл. обр. вследствие электростатич. взаимод., коор-динац. и водородных связей.
Важнейшие термодинамич. характеристики сольватации-энтальпия сольватации DHc и энергия Гиббса сольватации (своб. энергия сольватации) DGc, связанные соотношением:
DGc= DHc-ТDSc,
где DSc-энтропия сольватации, T-абс. т-ра. Энтальпия сольватации определяет тепловой эффект внедрения молекулы растворенного в-ва в р-ритель; энергия Гиббса сольватации определяет растворимость в-ва.
Наиб. простой способ эксперим. определения энтальпии сольватации состоит в непосредств. измерении теплового эффекта растворения в-ва А в р-рителе S-энтальпии растворения DHрА/S-и использовании соотношения:
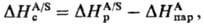
где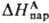 -энтальпия парообразования в-ва А. Благодаря развитию калориметрич. техники определение энтальпий растворения возможно практически для всех систем; осн. проблема состоит в корректном определении энтальпий парообразования. В то же время измерения значений DGc достаточно трудны, особенно в случаях сольватации ионов в неводных р-рах. Нередко вместо DGc вычисляют изменение этой величины D(DGc) относительно ее значения в водной среде, используя для этого стандартную молярную энергию DGп переноса иона X из воды W в к.-л. р-ритель S:
-энтальпия парообразования в-ва А. Благодаря развитию калориметрич. техники определение энтальпий растворения возможно практически для всех систем; осн. проблема состоит в корректном определении энтальпий парообразования. В то же время измерения значений DGc достаточно трудны, особенно в случаях сольватации ионов в неводных р-рах. Нередко вместо DGc вычисляют изменение этой величины D(DGc) относительно ее значения в водной среде, используя для этого стандартную молярную энергию DGп переноса иона X из воды W в к.-л. р-ритель S:
D(DGc) = DGп(X, W:S)=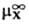 (в р-рителе S)-
(в р-рителе S)-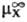 (в воде),
(в воде),
где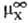 -стандартный хим. потенциал иона X (рассматривается бесконечно разб. р-р).
-стандартный хим. потенциал иона X (рассматривается бесконечно разб. р-р).
Структура ближайшего окружения частицы растворенного в-ва характеризуется координационными числами сольватации, определяемыми как кол-во молекул р-рителя, связанных достаточно долго с этой частицей, чтобы участвовать вместе с ней в диффузионном движении. Число сольватации зависит от природы растворенной частицы и р-рителя, а также в нек-рой степени от используемого метода определения; обычно используют данные по сжимаемости р-ра, скорости диффузии ионов, электропроводности, а также термохим. методы, электронное спиновое эхо и др. Для одновалентных ионов щелочных металлов и галогенов числа сольватации составляют от 0,5 до 5,0 (значения меньше 1 свидетельствуют о том, что в нек-рые моменты времени сольват-ная оболочка отсутствует).
В бинарных р-рителях, состоящих из нейтрального (не-полярного) и активного (полярного) компонентов, возникает селективная сольватация, при к-рой состав сольватной оболочки резко отличается от состава р-ра в целом. Особенно сильна селективная сольватация при малых концентрациях полярного компонента.
При исследовании динамич. поведения молекул в р-рах, их реакц. способности, для описания сольватации короткоживущих состояний используют понятие неравновесной сольватации (неравновесной среды), при к-рой состав и строение сольватных оболочек не отвечают минимуму своб. энергии системы, достижимому при условии бесконечности времени жизни данных состояний. Напр., состояния молекул, из к-рых происходит оптич. (излучательный) квантовый переход, всегда сольватированы неравновесно. Неравновесность среды определяется как вращательными, так и трансляц. степенями свободы молекул р-рителя. Релтаксация среды к равновесию происходит по закону ехр(-t/тL), где t- время, тL- характеристика релаксац. способности р-рителя. Для воды, напр., тL = 0,25·10-12 с.
Сольватирующая способность р-рителя оценивается по ряду эмпирич. параметров с использованием эмпирич. шкал р-рителей. Иногда пользуются понятием "сила р-рителя", основанным на предположении о независимости сольвати-рующей способности р-рителя от св-в растворяемого в-ва. Одной из наиб. универсальных характеристик сольвати-рующей способности р-рителя является его диэлектрич. проницаемость e.
Впервые влияние р-рителя на кинетику р-ций этерифика-ции было обнаружено М. Бертло в 1854; впоследствии Н.А. Меншуткин установил (1890), что хим. р-цию нельзя рассматривать отдельно от среды, в к-рой она протекает. Возможность теоретич. расчета влияния р-рителя на реакц. способность и статич. св-ва молекул растворенного в-ва определяется гл. обр. разработанностью теории жидкого состояния (см. Жидкость). В рамках статистич. теории, являющейся основой совр. представлений о структурных и энергетич. св-вах жидкостей и р-ров, полный потенциал F взаимод. молекулы растворенного в-ва со средой, находящейся в термодинамич. равновесии, имеет для одноцент-ровых частиц (напр., атомов благородных газов) вид:
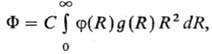
где R-расстояние между частицами, f(R)-потенциал парного взаимод. молекул, g(R)- радиальная корреляц. ф-ция распределения, С-постоянная, зависящая, в частности, от плотности среды. Потенциал F позволяет определить энергию межмол. взаимод., если известны ф-ции f(R) и g(R). Применительно к изучению сольватации такой подход сопряжен с большими математич. трудностями, т. к. не разработана общая теория, позволяющая с достаточной точностью вычислять для реальных систем энергию межмол. взаимод. в широкой области изменения R. Разработаны более простые, в т. ч. модельные, подходы к расчету DHc и DGc, в частности макроскопич. (континуальные) и микроскопич. (дискретные) способы описания эффектов сольватации. Континуальные методы основаны на моделях М. Борна, Л. Онсагера, Д. Кирквуда. Своб. энергия сольватации молекулы в среде равна:
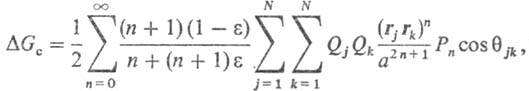
где а-радиус полости, вырезаемой в результате внедрения молекулы растворенного в-ва в р-ритель, Qj, Qk - эффективные заряды на j-м и k-м атомах этой молекулы, N - число атомов в ней, Рn-полиномы Лежандра, описывающие соотв. монопольные, дипольные, октупольные взаимод. и эффекты более высоких порядков, Од-углы, образованные векторами rj и rk, определяющими положения атомов у и k. Частными случаями данного ур-ния являются ур-ния для своб. энергии сольватации иона DG0-ур-ние Борна:
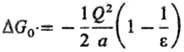
(Q-заряд иона) и ур-ние Онсагера (модель реактивного поля):
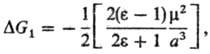
где m-дипольный момент молекулы растворенного в-ва. Несмотря на широкое использование ур-ния Онсагера, ряд опытных данных не подтверждается расчетом, напр. линейная зависимость энтальпии и своб. энергии сольватации от дипольного момента m.
Более точные расчеты в рамках микроскопии, подходов получены с использованием методов Монте-Карло и мол, динамики. В методе мол. динамики с помощью ЭВМ численно решают классич. ур-ния движения Ньютона, считая известной потенц. энергию взаимод. молекул. Это позволяет "наблюдать" за движением отдельных молекул жидкости, определять фазовые траектории, а затем усреднять их по времени и находить значения требуемых термодинамич. и структурных ф-ций. Метод позволяет рассчитать статич. и динамич. св-ва р-ров, в т. ч. и для неравновесных процессов. В методе Монте-Карло состояния рассматриваемой системы частиц считаются случайными, задача же состоит в отборе наиб. вероятных конфигураций и послед. усреднении по этим конфигурациям разл. св-в. Ввиду этого метод приспособлен для расчета лишь равновесных величин. Развитие ЭВМ позволяет применять оба метода ко все более широкому кругу объектов. В результате оказывается возможным корректное разделение энтальпий и своб. энергий сольватации на физически обоснованные вклады, связанные с разл. взаимод., и анализ зависимостей между ними. Методы Монте-Карло и мол. динамики позволяют рассчитывать энтальпии сольватации с точностью, сравнимой е экспериментальной (5-10 кДж/моль). Однако пока они не позволяют учитывать взаимную поляризацию р-рителя и растворенного в-ва, а также структурную перестройку в р-ре. Эти эффекты возможно определить с помощью квантовохим. расчетов, к-рые позволяют прогнозировать строение и св-ва изолир. молекул и механизмы р-ций, что необходимо для корректного выделения вклада, обусловленного непосредственно влиянием р-рителя. Поверхности потенциальной энергии молекул и реагирующих систем в газовой фазе и в р-рах могут иметь принципиально разл. профиль.
Сольватация приводит к тому, что тип р-рителя изменяет скорость хим. р-ций (до 109 раз), определяет относит. устойчивость таутомеров, конформеров, изомеров, влияет на механизм р-ций. Положения кислотно-основных равновесий в значит. степени определяются сольватирующей способностью р-рителя. Подробнее о влиянии сольватации на физ.-хим", характеристики растворенных в-в и их реакц. способность см. в ст. Реакции в растворах.
На влиянии сольватации на характеристики электронных спектров поглощения и испускания основано явление, наз. сольватохромией.
Лит.: Бургер К., Сольватация, ионные реакции и комплексообразование в неводных средах, пер. с англ., М., 1984; Симкин Б. Я." Шейхет И. И., Квантовохямичсская и статистическая теория растворов. Вычислительные методы и их применение, М., 1989; Solvents and solvent effects in organic chemistry, ed. by Ch. Reichardt, N.Y., 1988. Б.Я. Симкин.
