Ионный обмен
ИОННЫЙ ОБМЕН, обратимый процесс стехиометрич. обмена ионами между двумя контактирующими фазами. Обычно одна из фаз р-р электролита, другая - ионит. Диссоциация ионогенной группы ионита дает ионную пару, "фиксированный ион" к-рой ковалентно связан с каркасом (матрицей) ионита, а "противоион" подвижен и может обмениваться на ионы одноименного заряда, поступающие из "внешнего" р-ра. Благодаря эквивалентности обмена ионами обе фазы сохраняют электронейтральность в течение всего процесса. Принято рассматривать ионный обмен как гетерог. хим. р-цию обмена и количественно характеризовать ее одной из трех констант равновесия К: концентрационной (не учитывает коэф. активности компонентов); кажущейся (учитывает коэф. активности только в р-ре); термодинамической (учитывает коэф. активности в р-ре и фазе ионита). К определяют из ур-ния Никольского:K = (c1/a1)1/z1(a2/c2)1/z2
где c1 и с2 - концентрации или активности противоионов 1 и ионов 2 в равновесном р-ре, a1 и а2 - концентрации или активности ионов 1 и 2 в равновесной фазе ионита, z1 и z2 - зарядовые числа ионов. Изменение термодинамич. потенциала Гиббса в ходе ионного обмена подчиняется ур-нию: DG = — RTlnK. В процессе ионного обмена меняется также объем сорбента Q, совершается работа А изотермич. расширения (сжатия), причем A = pDQ, где p - осмотич. давление в фазе сорбента; поэтому суммарное значение DG = - RTlnK - pDQ. Однако в подавляющем большинстве случаев вторым членом ур-ния можно пренебречь. В простейшем случае ионного обмена система содержит два типа обменивающихся ионов и, следовательно, характеризуется четырьмя равновесными концентрациями (для каждого иона в р-ре и в ионите). Все задачи решаются на основе системы четырех ур-ний: баланса, изотермы ионного обмена, эквивалентности обмена и электронейтральности. Задачу нахождения К можно свести к эксперим. определению равновесной концентрации с одного компонента в р-ре. В случае обмена однозарядных ионов справедливо ур-ние а = Ка0с/[с0 + (К — 1)с], где а - равновесная концентрация иона в фазе ионита, а0 - обменная емкость ионита, с0 - концентрация исходного р-ра. Это ур-ние иллюстрирует связь вида изотермы со значением К (рис. 1).
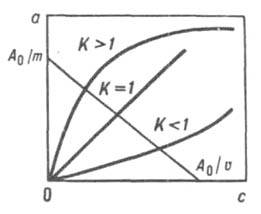
Рис. 1. Изотермы ионного обмена для систем с различными значениями констант равновесия (А0 - исходное кол-во в-ва, m - масса р-ра, v - объем р-ра).
При расчетах обмена смесей ионов на практике исходят из предположения, что значения К для каждого из компонентов в индивидуальных р-рах и в смеси тождественны. Это положение хорошо выполняется при сорбции микрокомпонентов на фоне макрокомпонента и в случае разб. (до 0,1 н.) р-ров любого состава. Сорбируемость ионов возрастает с увеличением заряда иона, у ионов с равными зарядами - с уменьшением степени их гидратации. При расчетах равновесий ионного обмена необходимо учитывать степень ионизации функциональных групп ионитов и степень диссоциации к-т и оснований в р-рах. Во многих реальных ионообменных системах ионный обмен сопровождается побочными явлениями, в первую очередь комплексообразованием, переносом р-рителя (воды), неэквивалентным обменом, окислит.-восстановит. р-циями. Значения К для сорбции на комплексообразующих сорбентах больше, чем К обычного ионного обмена. При ионном обмене многих орг. ионов помимо их удерживания ионогенными функц. группами сорбентов имеет место и дополнит. взаимод. этих ионов с матрицей сорбента (межмол. дисперсионные силы, водородная связь). Вследствие этого К для орг. соед. часто на 1-2 порядка выше, чем для неорганических. Поглощение воды ионитами сопровождается увеличением объема зерен и слоя сорбента и зависит от суммарного солесодержания р-ра и степени сшивки ионита. При расчетах, учитывающих поглощение воды (р-рителя), вода рассматривается как равноценный компонент ионообменной системы, а константа равновесия ионного обмена KW находится из ур-ния:
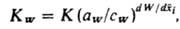
где К - термодинамич. константа равновесия ионного обмена, aW и cW - активности воды в фазе сорбента и р-ре, W - число молей воды, приходящееся на 1 эквивалент емкости ионита, 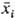 - эквивалентная доля i-гo компонента в сорбенте. Неэквивалентный ионный обмен обусловлен проникновением необменивающихся катионов и анионов электролита в фазу ионита, а также взаимод. не полностью диссоциированной многоосновной к-ты с функц. группами анионита или многозарядных оснований с катионитом. Окислит.-восстановит. р-ции для собственно ионообменных сорбентов обычно обусловлены низкомол. примесями в них, удаляемыми предварит. обработкой сорбентов к-тами, щелочами, окислителями.
- эквивалентная доля i-гo компонента в сорбенте. Неэквивалентный ионный обмен обусловлен проникновением необменивающихся катионов и анионов электролита в фазу ионита, а также взаимод. не полностью диссоциированной многоосновной к-ты с функц. группами анионита или многозарядных оснований с катионитом. Окислит.-восстановит. р-ции для собственно ионообменных сорбентов обычно обусловлены низкомол. примесями в них, удаляемыми предварит. обработкой сорбентов к-тами, щелочами, окислителями.
Кинетика. Процесс ионного обмена включает 5 последоват. стадий: перемещение сорбируемого иона к пов-сти зерна сорбента (1) и внутри него (2), собственно ионный обмен (3), перемещение вытесняемого иона внутри зерна сорбента (4) и от его пов-сти в р-ре (5). Все стадии, кроме собственно хим. р-ции обмена, носят диффузионный характер. Лимитирующую стадию определяют экспериментально: если это хим. р-ция обмена, то скорость процесса не зависит от размера зерен сорбента; если внутр. диффузия, то сорбция возрастает после перерывов в опыте (явление "отдыха"); если внеш. диффузия, то скорость поглощения зависит от интенсивности перемешивания в статич. условиях или от скорости прохождения р-ра в динамич. опыте. Расчеты диффузионных стадий базируются на законах Фика (см. Диффузия). Коэф. диффузии определяют экспериментально, их значения для внеш. диффузии порядка 10-5 см2/с, для внутренней - от 10-6 до 10-11 см2/с. Коэф. внутр. диффузии орг. ионов на 1-2 порядка меньше, чем неорг. ионов. Особо крупные орг. ионы (напр., антибиотиков) не проникают во внутр. часть зерен малонабухающих (даже слабосшитых) сорбентов, в результате чего наблюдается состояние "ложного" равновесия. Поэтому для эффективной реализации таких процессов часто рекомендуют использовать т. наз. поверхностно-слоистые сорбенты, в к-рых ионогенные группы расположены тонким слоем вблизи пов-сти зерен. Уменьшение пути диффузии в результате уменьшения размера зерен (соотв. и межзернового пространства) приводит к резкому увеличению скорости ионного обмена. Вследствие малой энергии активации диффузии скорость ионного обмена мало зависит от т-ры.
Динамика. Большинство ионообменных процессов проводится в динамич. условиях - пропусканием р-ра через неподвижный слой сорбента в периодич. процессах или противоточным движением р-ра и сорбента в непрерывных процессах (рис. 2). Преимущества динамич. способа -глубокая очистка р-ра от примесей (благодаря контакту со свежими порциями сорбента) и полное использование обменной емкости слоя (вследствие увода током р-ра продуктов ионообменной р-ции из сферы р-ции).
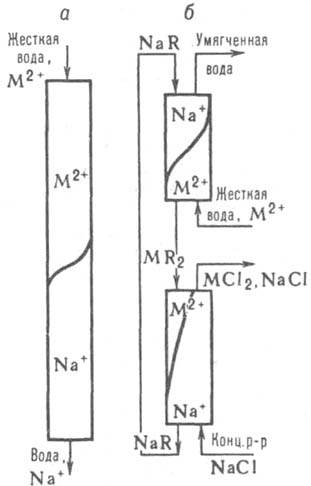
Рис. 2. Схемы ионообменного умягчения воды (М = Са, Mg) на неподвижном слое сорбента (а) и в противотоке (б) с движущимися слоями сорбента (NaR, MR2) и потоками р-ров (умягчаемая вода и регенерирующий р-р NaCl).
Для характеристики сорбционной способности ионита в динамич. условиях используют ур-ние Шилова: q = kX — t, где q - время защитного действия слоя сорбента, Х - длина слоя сорбента, k - коэф. защитного действия слоя, зависящий от величины равновесной адсорбции, концентрации иона в р-ре и скорости потока р-ра, t - потеря времени защитного действия слоя. Все расчеты динамики ионного обмена базируются на решении системы ур-ний для каждого компонента. Ур-ние баланса имеет вид:
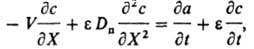
где V - линейная скорость потока р-ра, e - порозность сорбента (объем межзернового пространства в долях от общего объема сорбента), Dп - коэф. продольной диффузии, t - время от начала опыта до "проскока" - появления удаляемого компонента за слоем сорбента. Во мн. случаях членами, отражающими продольную диффузию (за исключением стадии регенерации) и изменение концентрации в р-ре, можно пренебречь. Тогда ур-ние баланса принимает вид:
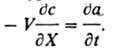
Применение. Процессы ионного обмена используют в аналит. химии и в пром-сти. С помощью ионного обмена концентрируют следовые кол-ва определяемых в-в, определяют суммарное солесодержание р-ров, удаляют мешающие анализу ионы, количественно разделяют компоненты сложных смесей (см. Ионообменная хроматография). Ионный обмен применяют: для получения умягченной и обессоленной воды (см. Водоподготовка) в тепловой и атомной энергетике, в электронной пром-сти; в цветной металлургии - при комплексной гидрометаллургич. переработке бедных руд цветных, редких и благородных металлов; в пищ. пром-сти - в произ-ве сахара, при переработке гидролизатов; в мед. пром-сти - при получении антибиотиков и др. лек. ср-в, а также во мн. отраслях пром-сти -для очистки сточных вод в целях организации оборотного водоснабжения и извлечения ценных компонентов, очистки воздуха. Разрабатываются ионообменные методы комплексного извлечения из океанской воды ценных микрокомпонентов. Промышленные аппараты для реализации ионного обмена. Подразделяются на 3 группы: установки типа смесителей-отстойников, фильтры с неподвижным и подвижным слоями сорбента. Аппараты первого типа используют в гидрометаллургии. В фильтрах с неподвижным слоем сорбента исходные и регенерац. р-ры подаются в одном направлении (поточные схемы) или в противоположных (противоточные схемы). Такие аппараты используются для ионообменной очистки р-ров, напр., при умягчении и обессоливании воды. В непрерывно действующих противоточных аппаратах подвижный сорбент, как правило, перемещается сверху вниз под действием силы тяжести. Конструктивно противоточные аппараты подразделяются на 3 группы: со взвешенным или кипящим слоем ионита, с непрерывным движением плотного слоя, с попеременным движением р-ра через неподвижный слой и перемещением слоя при прекращении движения р-ра. Для разделения смесей близких по св-вам компонентов (напр., изотопов) используют малопроизводительные, но эффективные аппараты с поочередным движением фаз и со сплошным слоем периодически выгружаемого сорбента. Технол. схема ионного обмена включает: сорбцию извлекаемых или удаляемых элементов, взрыхление слоя ионита (током р-ра снизу вверх), регенерацию ионита, промывку слоя ионита от регенерирующего р-ра. Литература
