§ 2. Комплексообразование
Рассмотренные в предыдущем параграфе реакции присоединения аммиака не укладываются в рамки обычных представлений о валентной связи. Действительно, молекулы и самого аммиака и вступающего с ним во взаимодействие вещества (например, НСl) электрически нейтральны и образованы в полном соответствии с требованиями теории валентности. Ни одно из вступающих в реакцию веществ не содержит, следовательно, способных осуществить валентную связь непарных электронов. Между тем опыт показывает, что присоединение все же имеет место.
Указания на характер протекающего при взаимодействии аммиака с кислотами процесса дают сами свойства получающихся продуктов – солей аммония. Так как последние в растворе всегда отщепляют ион NH4 +, при образовании их должно происходить соединение нейтральной молекулы аммиака с ионом водорода. Для реакции, например, между NH3 и НСl это может быть наглядно выражено следующей схемой:
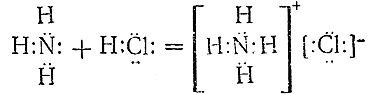
Из схемы вытекает, что азот аммиака перетягивает к себе ион водорода от хлора. В противоположность химическим реакциям, ведущим к возникновению обычных валентных связей (III § 4), рассматриваемый процесс не сопровождается образованием новых электронных пар (или, по Косселю, переходом электронов). Подобные хлористому аммонию молекулярные соединения определенного состава, образование которых из более простых молекул не связано с возникновением новых электронных пар, называются комплексными. В качестве отдельно рассматриваемой составной части ряда сходных комплексных соединений часто бывает целесообразно выделять комплексный ион. Например, комплексный ион NH4 содержится во всех солях аммония, которые сами являются комплексными соединениями.
1) Существуют два основных подхода к теории образования комплексных соединений. С точки зрения электростатического подхода образование комплексного соединения происходит за счет кулоновского притяжения частиц и их взаимной поляризации. Например, при взаимодействии аммиака с НСl ион водорода одновременно притягивается и ионом хлора, и азотом аммиака Так как притяжение азотом выражено более сильно, образуется соль аммония с катионом NH4 и анионом Cl– на которые она и распадается при растворении в воде.
В основе другого подхода лежит допущение существования так называемой донорно–акцепторной (иначе, координативной) связи По этим представлениям, обладающие свободными электронными парами атомы имеют тенденцию использовать их для связи с другими частицами. Вместе с тем не обладающие законченной электронной конфигурацией атомы имеют тенденцию пополнить свой внешний электронный слой путем использования чужих электронных пяр. Атомы первого типа носят название доноров, второго – акцепторов Если обе тенденции выражены достаточно сильно, то между атомами возникает связь за счет электронной пары донора. Например, образование иона NH4 происходит за счет свободной электронной пары атома N и имеет место потому, что азот аммиака является лучшим донором, чем ион хлопа.
При сопоставлении процессов образования обычной валентной и донорно–акцепторной связей получаются следующие схемы:
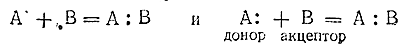
Из этих схем видно, что оба процесса различаются происхождением связующей электронной пары, но сами образующиеся в конечном счете связи однотипны (и имеют более или менее четко выраженный ковалентный характер).
В структурных формулах соединений донорно–акцепторную связь обозначают не простой чертой (как обычную валентную), а стрелкой, направленной от донора к акцептору. Приведенные выше схемы можно было бы поэтому переписать следующим образом:
A· + B = А–B
и
A: + B = A––>B
2) Обе рассмотренные выше точки зрения не исключают, а взаимно дополняют друг друга. Это становится ясным, если учесть, что дальность действия различных сил существенно зависит от их природы:

Как видно из схемы, последовательно сближающиеся частицы первоначально взаимодействуют друг с другом только электростатически, Если по каким–либо причинам дальнейшее сближение невозможно, то дело этим практически ограничивается. Напротив, если частицы могут подойти друг к другу, достаточно близко (на расстояние, не слишком превышающее сумму радиусов непосредственно сближающихся атомов), то становится возможным образование обычных ковалентных и донорно–акцепторных связей. Прочность последних и их относительное значение в обшей энергии комплексной связи все более возрастают по мере дальнейшего сближения частиц.
Из изложенного следует, что в общем случае комплексную связь можно рассматривать как сочетание электростатической и донорно–акцепторной. Лишь тогда, когда значение какого–либо из этих видов взаимодействия настолько доминирует, что практически допустимо считаться только с ним, становится приближенно правильной одна из рассмотренных выше трактовок.
Приведенная схема образования NH4 Cl наглядно показывает, что центральное положение в этом комплексном соединении В занимает азот. Такой центральный атом (или ион) называется комплексообразователем. Другие составные части рассматриваемого комплексного соединения по отношению к комплексообразователю расположены различно: в то время как водороды непосредственно связаны с ним (находятся во внутренней сфере комплекса), ион хлора более удален (находится во внешней сфере) и, следовательно, связан значительно слабее, Различие между внутренней и внешней сферами часто оттеняют в формулах тем, что заключают первую (вместе с комплексообразователем) в квадратные скобки. Например, написание хлористого аммония в комплексной форме будет [NH4 ]Cl. Как эта формула, так и приведенная выше схема подчеркивают полную равноправность всех четырех расположенных около азота водсродов, независимо от того, какой именно из них заключался в первоначально взятом аммиаке и какой был присоединен впоследствии.
3) Очевидно, что перетягивание иона водорода к азоту аммиака будет происходить тем легче, чем слабее он удерживается кислотным остатком соответствующей кислоты (т. е. чем последняя сильнее), Поэтому теплоты образования солей аммония и сильных кислот больше, чем слабых. Например, для НСl и Н2 О (рассматривая ее как слабую кислоту) имеем:
NH3 + HCl = NH4 Сl + 42 ккал
и
NH3 + НОН = NH4 OH + 8 ккал
Наоборот, разложение солей аммония на аммиак и кислоту идет тем легче, чем сильнее кислотный остаток притягивает ион водорода (т. е. чем кислота слабее). Поэтому, например, NH4 Cl разлагается только около 300 °С, тогда как свободный NH4 OH совершенно неустойчив уже при обычной температуре.
Образование комплексных соединений рассматривалось выше на примере аммонийных солей, где комплексообразователем является азот аммиака. Однако значительно чаще приходится иметь дело с комплексообразованием около свободных ионов.
Для рассмотрения этого случая обратимся прежде всего к взаимодействию ионов с молекулами воды. Как уже отмечалось ранее (V § 4), под действием создаваемого ионом электрического поля молекулы воды определенным образом ориентируются и затем притягиваются к иону противоположно заряженным концом диполя. За счет такого притяжения в растворе образуется гидра–тированный ион. Допустим теперь, что раствор все более концентрируется. На известной стадии из него станут выделяться кристаллы растворенного вещества, заключающие в своем составе и рассматриваемый ион. Если при этом непосредственно окружающие его в растворе молекулы воды связаны с ним непрочно, то вода не войдет в состав кристалла. Напротив, если связь иона с молекулами воды достаточно прочна, то в состав кристалла он войдет с некоторым числом молекул «кристаллизационной» воды. В результате получится кристаллогидрат данного вещества, представляющий собой, по существу комплексное соединение. Например, фиолетовый кристаллогидрат СrСl3 ·6Н2 О является в действительности комплексным соединением [Сr(ОН2 )6 ]Сl3 , в котором около комплексообразователя (Сr3+) удерживаются во внутренней сфере шесть молекул воды. Подобным же образом как комплексные соединения следует рассматривать и многие другие кристаллогидраты солей.
Очевидно, что образование комплексного соединения может происходить при взаимодействии иона не только с водой, но и с другими нейтральными молекулами. Например, при действии аммиака на водный раствор СuСl2 образуется комплекс состава [Cu(NH3 )4 ]Cl2 , диссоциирующий на ионы [Cu(NH3 )4 ]2+и 2Сl–. С другой стороны, комплексообразование не обязательно должно протекать в растворе – комплексные соединения часто образуются и при взаимодействии твердых веществ с газообразными. Например, безводный СаСl2 в атмосфере аммиака дает комплекс состава [Ca(NH3 )8 ]Cl2 . Сущность самого процесса остается при этом той же самой и заключается в присоединении нейтральных молекул к тому или иному иону соли за счет возникающего между ними взаимного притяжения.
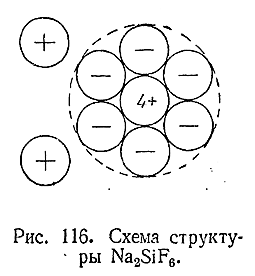
Такое притяжение действует не только между ионом и нейтральной молекулой, но в еще большей степени между разноименно заряженными ионами. Пусть, например, к какому–либо положительному иону притягивается одновременно несколько отрицательных. Если при этом взаимное отталкивание последних слабее их притяжения к комплексообразователю, то получающаяся группировка может оказаться настолько устойчивой, что будет существовать как таковая и в твердом состоянии и в растворе. Например, в Na2 [SiF6 ] ионы фтора притягиваются к Si4+сильнее,чем отталкиваются друг от друга(рис. 116). Соединение это диссоциирует вводном растворе по схеме:
Na2 [SiF6 ] < = > 2Na+ + [SiF6 ]2–
Наконец, вполне возможен случай, когда к данному иону одновременно будут притянуты и ионы противоположного знака и нейтральные молекулы. Если при этом и те и другие удерживаются комплексообразо–вателем достаточно прочно, комплексное соединение подобного типа, например [Pt(NH3 )4 Cl2 ]Cl2 , будет устойчиво, давая в растворе катионы [Pt(NH3 )4 Cl2 ]2+ и анионы хлора.
4) То, что в [Pt(NH3 )4 Cl2 ]Cl2 легко диссоциируют только два иона хлора, а два остальных более прочно удерживаются во внутренней сфере комплекса, устанавливается на опыте. Так, если к раствору этого соединения добавить AgNO3 , то тотчас выпадает осадок AgCl Взвешивание его и соответствующий расчет показывают, что из содержащихся в молекуле четырех ионов хлора в виде AgCl сразу осаждаются только два. Следовательно, только два иона Сl– из четырех и находятся во внешней сфере. Наряду с результатами полного химического анализа это и обосновывает приведенную формулу.
Из изложенного вытекает, что комплексные соединения могут быть весьма разнообразны, так как в состав внутренней сферы способны входить и ионы, и нейтральные молекулы, и те и другие вместе. Общее число таких частиц, образующих внутреннюю сферу около данного комплексообразователя, называется его координационным числом. Так, в рассмотренных выше примерах координационные числа имели значения: 4 – для азота, 6 – для Сr3+, 4 –для Сu2+, 8– для Са2+ и 6 –для Si4+.
Для определения заряда образовавшегося комплексного иона значение имеет, с одной стороны, заряд самого комплексообразователя, с другой – заряды входящих во внутреннюю сферу ионов противоположного знака и их число (входящие во внутреннюю сферу молекулы при определении заряда не учитываются, так как в целом они электронейтральны). Например, в случае [Cu(NH3 )4 ]Cl2 двойной положительный заряд комплексообразователя (Сu2+) сохраняется и для всего комплексного катиона.
В случаях К2 [РtСl6 ] и |Pt(NH3 )4 Cl2 ]Cl2 сам комплексообразователь (Pt4+) имеет четыре положительных заряда (точнее, он – положительно четырехвалентен), а ионы – [PtCl6 ]2–и [Pt(NH3 )4 Cl2 ]2+– несут соответственно два отрицательных и два положительных.
С другой стороны, заряд комплексного иона должен численно равняться суммарному заряду ионов внешней сферы и быть противоположным ему по знаку. Отсюда опять–таки легко определить заряд комплексного иона. Например, у K2 [PtCl6 ] во внешней сфере находятся два положительно заряженных иона калия. Следовательно, сам комплексный ион имеет два отрицательных заряда.
Зная состав комплексного соединения, легко найти и заряд комплексообразователя: он должен быть численно равен и противоположен по знаку алгебраической сумме зарядов всех остальных входящих в формулу ионов. Например, для K2 [PtCl6 ] эта сумма равна (2 + ) + (6–) = (4–). Следовательно, комплексообразователь (Pt) в данном соединении положительно четырехвалентен.
Насколько разнообразны комплексные соединения по своему составу, настолько же разнообразны они и в отношении устойчивости внутренней сферы. Хотя при диссоциации, например, K2 [PtCl4 ] наряду с равновесием
K2 [PtCl4 ] < = > 2K+ + [PtCl4 ]2–
имеет место также равновесие по суммарной схеме
[PtCl4 ]2– < = > Pt2+ + 4Cl–
однако последнее настолько смещено влево, что ионов Pt2+и Cl–в растворе почти нет.
Напротив, для комплекса, например, K2 [CuCl4 ] аналогичное равновесие
[CuCl4 ]2– < = > Cu2+ + 4Cl–
настолько смещено вправо, что в разбавленных растворах почти нет комплексных ионов [CuСl4 ]2–. Между подобными крайними случаями располагается ряд промежуточных, когда в растворе одновременно имеются значительные количества и самих комплексных ионов и продуктов их диссоциации.
5) Устойчивость внутренней сферы комплексного соединения в водном растворе количественно оценивается значением характерной для нее константы диссоциации (т. н. константы нестойкости комплекса). Чем меньше эта величина, тем устойчивее внутренняя сфера (при данном координационном числе). Например, для комплексных ионов [Ag(NH3 )2 ]+и [Ag(CN)2 ]–соответствующие выражения имеют вид:

Отсюда видно, что второй комплекс гораздо устойчивее первого.
Как K2 [PtCl4 ], так и К2 [СuСl4 ] образуются из нейтральных солей по схемам PtCl2 + 2KCl и СuСl2 + 2КСl. Хотя оба эти соединения одинаково подходят под определение комплексных, однако подобные K2 [СuСl4 ] вещества с малоустойчивой внутренней сферой часто называют двойными солями и обозначают их следующим образом: CuСl2 ·2КСl. Такой же способ обозначения применяют обычно и по отношению к кристаллогидратам.


