Поляризация
ПОЛЯРИЗАЦИЯ в электрохимии, отклонение значения электродного потенциала от равновесного при пропускании электрич. тока. Величина поляризации зависит от плотности тока i, т.е. силы тока, отнесенной к единице пов-сти электрода, и обычно тем больше, чем больше i. При одном и том же значении i поляризация зависит от природы электрода и типа протекающей на его пов-сти р-ции, состава р-ра, т-ры и др. факторов и может колебаться от долей мВ до неск. В. Знак поляризации зависит от направления протекания тока и при изменении направления меняется на обратный.
Причиной поляризации служит малая скорость одной или нескольких стадий суммарного электродного процесса. Если лимитирующей стадией является подвод реагирующего в-ва к пов-сти электрода, поляризация обусловлена тем, что из-за протекания тока концентрация cs в-ва у пов-сти отличается от объемной концентрации сu (концентрационная поляризация). В простейшем случае разряда ионов металла на электроде из того же металла или анодного растворения металла концентрационная поляризация |DE| = [RT/nF]ln(cs/сu), где n-число электронов, участвующих в электродном процессе, T-т-ра, F- постоянная Фарадея, R - газовая постоянная. При катодном осаждении металла DЕ < 0, при анодном растворении металла DЕ > С. Связь между величинами DЕ и i может быть выражена в виде:
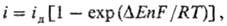
где iд - предельный диффузионный ток, отвечающий условию cs = 0. Из этого ур-ния следует, что при |DЕ|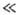 RT/nF зависимость между i и DЕ линейна. При больших отрицат. DЕ примерно i = iд, а при больших положит. DЕ (анодное растворение металла) i экспоненциально возрастает с ростом DЕ.
RT/nF зависимость между i и DЕ линейна. При больших отрицат. DЕ примерно i = iд, а при больших положит. DЕ (анодное растворение металла) i экспоненциально возрастает с ростом DЕ.
Если лимитирующей стадией электродного процесса является перенос электронов через границу электрод/р-р, т.е. собственно электрохим. стадия, поляризация наз. электрохимической или перенапряжением, и обычно обозначается буквой h. При |h|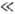 RT/F зависимость между h и i линейна. При больших |h| в простейших случаях наблюдается линейная зависимость между |h| и lgi, часто наз. тафелевской, т.к. формально подчиняется Тафеля уравнению.
RT/F зависимость между h и i линейна. При больших |h| в простейших случаях наблюдается линейная зависимость между |h| и lgi, часто наз. тафелевской, т.к. формально подчиняется Тафеля уравнению.
Если электродный процесс осложнен хим. р-цией, к-рая предшествует электрохим. стадии или следует за ней, то поляризация может быть обусловлена конечной скоростью этой р-ции (хим. стадии). При зарождении новой фазы на пов-сти электрода возникновение поляризации связано со стадиями образования двухмерных или трехмерных зародышей, поверхностной диффузией адсорбир. атомов или ионов, встраиванием их в кристаллич. решетку и т.п.
Поляризация может быть вызвана сразу неск. стадиями процесса (смешанная поляризация). Различение составляющих, обусловленных отдельными стадиями, возможно только при малых значениях поляризации. Идентификация вида поляризации требует исследования влияния на протекание электродного процесса разл. факторов: энергичного перемешивания электролита, что выявляет кинетич. закономерности стадии разряда - ионизации, состава р-ра, зависимости между поляризацией и i и др. Иногда вместо термина "поляризация" используют термин "перенапряжение" с указанием причины, вызывающей его возникновение (диффузионное перенапряжение, электрохим., хим. образование зародышей и т.п.).
Поляризация приводит к бесполезной трате электрич. энергии, т.к. снижает полезное напряжение химического источника тока и повышает напряжение, к-рое необходимо приложить к электролизеру при проведении электролиза. Однако в не-к-рых случаях благодаря поляризации исключается возможность протекания нежелат. побочных процессов. Так, из-за поляризации, затрудняющей электролитич. выделение Н2 и O2 из Н2О, можно в водных р-рах достичь эдс источников тока 2,0-2,2 В, что существенно превышает термодинамически равновесное значение 1,23 В.
Лит.: Дамаскин Б. Б., Петрий О. А., Введение в электрохимическую кинетику, 2 изд., М., 1983; их же, Электрохимия, М., 1987. О. А. Петрий.
