Анодное растворение
АНОДНОЕ РАСТВОРЕНИЕ металла, электрохим. окисление металла в р-ре или расплаве электролита с образованием р-римых продуктов и отводом освобождающихся электронов во внеш. цепь. В общем виде этот процесс можно записать след. образом:
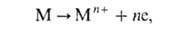
где М-атом металла, n-число освобождающихся электронов. В соответствии с законами Фарадея, в отсутствие др. электродных р-ций зависимость между скоростью окисления металла V [г/(см2*с)] и плотностью анодного тока i имеет вид: 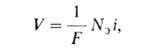
где F- постоянная Фарадея, Nэ-xим. эквивалент металла.
Анодное растворение лежит в основе размерной электрохим. обработки металлов и сплавов и их электрополировки, анодного упрочнения металлич. материалов путем удаления с повети тонких механически деформиров. слоев, использования р-римых анодов при электрохим. рафинировании металлов и в гальванотехнике. От анодного растворения в значит. мере зависят эксп-луатац. характеристики гальванич. элементов и аккумуляторов, а также коррозионное поведение конструкц. металлич. материалов.
Важнейшие характеристики анодного растворения-зависимость i от электродного потенциала Е и частная производная обратной зависимости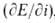 , наз. поляризуемостью и являющаяся техн. характеристикой растворяющихся анодов. Указанные зависимости могут иметь концентрац. или кинетич. (активационную) природу. Какой из случаев реализуется на практике, зависит от соотношения между i при данном Е и током обмена iо, т.е. плотностью тока при равновесном потенциале, когда она в точности равна плотности тока обратного процесса - катодного осаждения металла. При i < iо скорость анодного растворения лимитируется скоростью отвода продуктов окисления от пов-сти электрода в объем р-ра; потенциал металла сохраняет равновесное значение по отношению к его ионам в приповерхностном слое р-ра и выражается ур-нием Нернста:
, наз. поляризуемостью и являющаяся техн. характеристикой растворяющихся анодов. Указанные зависимости могут иметь концентрац. или кинетич. (активационную) природу. Какой из случаев реализуется на практике, зависит от соотношения между i при данном Е и током обмена iо, т.е. плотностью тока при равновесном потенциале, когда она в точности равна плотности тока обратного процесса - катодного осаждения металла. При i < iо скорость анодного растворения лимитируется скоростью отвода продуктов окисления от пов-сти электрода в объем р-ра; потенциал металла сохраняет равновесное значение по отношению к его ионам в приповерхностном слое р-ра и выражается ур-нием Нернста:
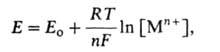
где Ео- стандартный электродный потенциал, [Мп+]- при-поверхностная концентрация ионов металла, Т-абс. т-ра, R-газовая постоянная. Однако, оставаясь равновесным, потенциал меняется, т.к. [Мn+] у пов-сти возрастает пропорционально скорости анодного растворения (т.е. плотности тока i). Соотв. зависимость Е от i описывается ур-нием:
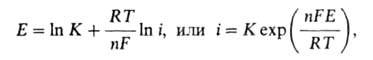
где К - эмпирич. коэффициент. Это ур-ние м.б. нарушено, когда будет достигнут предел р-римости соли, образуемой металлом с одним из анионов электролита, и [М ] перестанет расти. Если образующийся при этом осадок рыхлый и заметно не препятствует прохождению тока, то далее металл становится практически неполяризуемым. Такова, напр., природа неполяризуемости отрицат. пластины свинцового аккумулятора.
В водных р-рах электролитов поляризуемость описанного концентрац. типа характерна для переходных металлов I и II групп (Ag, Cu, Zn, Cd), к-рым свойственны высокие значения iо. Ее важнейшая особенность - зависимость Е не только от i, но и от интенсивности перемешивания р-ра.
При i > iо растворение протекает с кинетич. контролем, т.е. лимитируется собственно электрохим. стадией - переносом заряженной частицы через границу металл-р-р, и его скорость изменяется с потенциалом Е по закону: 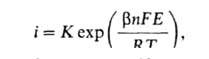
где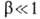 -т. наз. коэф. переноса. Этот тип поляризуемости особенно характерен для переходных металлов VIII группы (Fe, Ni, Co и др.), к-рые отличаются низкими значениями iо.
-т. наз. коэф. переноса. Этот тип поляризуемости особенно характерен для переходных металлов VIII группы (Fe, Ni, Co и др.), к-рые отличаются низкими значениями iо.
На лимитирующую стадию, а значит, и на весь процесс может сильно влиять предшествующая ей стадия адсорбционного и хим. взаимод. поверхностных атомов металла с компонентами р-ра (молекулами р-рителя, анионами электролита). С учетом этой стадии механизм и скорость анодного растворения можно выразить таким образом:
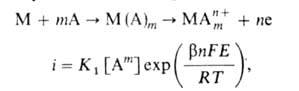
где А - адсорбирующийся компонент р-ра, т- число его молекул, участвующих в процессе, К1- константа. В зависимости от условий адсорбция может стимулировать или ингибировать анодное растворение (т м. б. положительным или отрицательным). Соотв. введение в р-р или удаление из него адсорбирующихся компонентов - один из эффективных методов регулирования скорости анодного растворения в технике. Стимуляторы широко используют в технологии размерной электрохим. обработки металлов, а также для снижения поляризуемости растворяющихся анодов. Использование ингибиторов анодного растворения - один из важных методов защиты металлов от коррозии (см. Ингибиторы коррозии).
Анодное растворение, конечными продуктами к-рого являются многовалентные катионы или их комплексы, протекает, как правило, через ряд одноэлектронных стадий (п — 1), каждая из к-рых в зависимости от условий может оказаться лимитирующей. При этом промежут. ионы металла низких степеней окисления нередко доокисляются до устойчивого состояния не только (а иногда не столько) электрохимически, но и в результате непосредственного взаимод. с окислит. компонентой р-ра (молекулы растворенного кислорода, ионы Н+ ), напр. по р-ции:
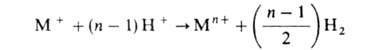
В подобных случаях итоговая скорость анодного растворения может существенно превосходить величину, рассчитанную только по току.
Нередко анодное растворение осложняется вторичными явлениями. Так, образование на пов-сти растворяющегося металла фазовых или адсорбционных солевых или оксидных слоев приводит к пассивации анодного растворения (см. Пассивность металлов), к-рая проявляется в ослаблении зависимости его скорости от потенциала, в достижении предельной плотности тока растворения, а иногда и в изменении типа зависимости. В водных средах повыш. склонностью к пассивации отличаются мн. переходные металлы (Mo, Cr, Ni, Fe и др.). Для них характерен критич. потенциал Екр, зависящий от природы металла и рН р-ра. При достижении Екр обычное увеличение скорости анодного растворения сменяется ее резким снижением, иногда до неск. порядков величины. После этого в большом интервале значений потенциала скорость анодного растворения сохраняется постоянной, а затем снова начинает экспоненциально расти с потенциалом (см. рис.). Последнее явление, известное как перепассивация, обусловлено новым анодным процессом (окислением металла до ионов высшей валентности), к-рый лежит в основе электрохим. технологии получения высших кислородных соед. ряда металлов, напр. Mn, Cr. При анодном растворении сплава возможен неравномерный переход его компонентов в р-р, т.е. избирательное растворение одних компонентов и обогащение поверхностного слоя сплава другими.
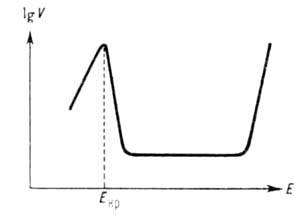
Зависимость логарифма скорости анодного растворения ог электродного потенциала.
Литература
Колотыркин Я. М., "Природа", 1979, № 11, с. 2-13: его же, ".Защита металлов", 1983, т. 19, № 5, с. 675-85; Основы теории и практики электрохимической обработки металлов и сплавов, М., 1981. Я.М. Колотыркин.
