Ток обмена
ТОК ОБМЕНА (плотность тока обмена), осн. параметр электрохимической кинетики, характеризующий равные по величине скорости катодного и анодного процессов при равновесном электродном потенциале Ер; обозначается i0. Согласно теории замедленного разряда, для окислит.-вос-становит. р-пии типа Ох + ne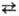 Red при потенциале E скорости катодного (прямого)
Red при потенциале E скорости катодного (прямого)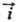 и анодного (обратного)
и анодного (обратного)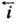 про цессов равны соотв.:
про цессов равны соотв.:
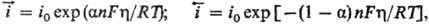
где h = Ep — Е- сдвиг потенциала электрода по отношению к его равновесному значению (см. Поляризация), a-эмпирич. постоянная, наз. коэффициентом переноса (0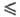 a
a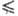 1), Т- абс. т-ра, F - постоянная Фарадея, R - газовая постоянная. При E = Ep h = 0 и
1), Т- абс. т-ра, F - постоянная Фарадея, R - газовая постоянная. При E = Ep h = 0 и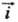 =
=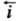 = i0. Проходящий через электрохим. цепь измеряемый (внешний) катодный ток i =
= i0. Проходящий через электрохим. цепь измеряемый (внешний) катодный ток i =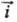 -
-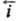 . При условии h
. При условии h RT/F!25 мВ
RT/F!25 мВ 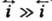 и i!
и i!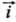 , откуда следует, что
, откуда следует, что
h = -(RT/anF)lni0 + RT/anFlni
(см. Тафеля уравнение). С другой стороны, при |h| RT/F h = iRT/nFi0. Т. обр., внеш. ток i вызывает тем большие отклонения от равновесного значения электродного потенциала, чем меньше i0. С ростом концентрации в-в Ох и Red и их адсорбируемости на пов-сти электрода ток обмена увеличивается.
RT/F h = iRT/nFi0. Т. обр., внеш. ток i вызывает тем большие отклонения от равновесного значения электродного потенциала, чем меньше i0. С ростом концентрации в-в Ох и Red и их адсорбируемости на пов-сти электрода ток обмена увеличивается.
Приведенные выше ф-лы позволяют рассчитать ток обмена на основе эксперим. зависимости h от i. Для одной и той же р-ции катодного выделения Н2 в зависимости от природы электрода и состава р-ра ток обмена может изменяться от 10-13 до 10 А/см2. Независимый метод определения тока обмена основан на использовании радиоактивных изотопов. Напр., при E = Ер приводят в контакт амальгаму цинка, содержащую радиоактивный изотоп Zn, С р-ром соли цинка со стабильным изотопом и измеряют рост радиоактивности р-ра во времени. Скорость перехода радиоактивного изотопа в р-р определяется величиной тока обмена, поэтому его можно рассчитать по изменению радиохим. активности р-ра.
Лит.: Дамаскин Б. Б., Петрий О.А., Введение в электрохимическую кинетику, 2 изд., М., 1983, с. 234. Б. Б. Дамаскин.
