Электрохимическая кинетика
ЭЛЕКТРОХИМИЧЕСКАЯ КИНЕТИКА, раздел теоретич. электрохимии, рассматривающий закономерности, к-рым подчиняется скорость электродных процессов. Электрич. ток, проходящий через границу электрод - ионная система, связан с протеканием электродного процесса (фарадеевский ток) и с заряжением двойного электрического слоя (ток заряжения). Если св-ва пов-сти электрода не изменяются во времени, протекающий через электрод ток определяется только скоростью самого электродного процесса и размерами электрода. В этих условиях плотность тока i служит мерой скорости электрохим. р-ции. Если электрод находится при равновесном потенциале Ер, ток i = 0. При пропускании через электрод электрич. тока потенциал электрода отклоняется от Ер на величину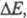 к-рая называется поляризацией электрода. Для величины
к-рая называется поляризацией электрода. Для величины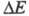 часто используют термин "перенапряжение" (обозначение
часто используют термин "перенапряжение" (обозначение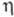 ).
).
Поляризация электрода обусловлена конечной скоростью электродного процесса, а потому она является ф-цией плотности тока. Функциональная зависимость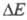 от i (или i от
от i (или i от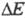 ) называется поляризационной характеристикой электрода. Задача электрохимической кинетики заключается в установлении общих закономерностей, к-рым подчиняются поляризационные характеристики электродов, с целью регулирования скорости электродных процессов. Решение задач электрохимической кинетики имеет большое практич. значение, поскольку уменьшение поляризации
) называется поляризационной характеристикой электрода. Задача электрохимической кинетики заключается в установлении общих закономерностей, к-рым подчиняются поляризационные характеристики электродов, с целью регулирования скорости электродных процессов. Решение задач электрохимической кинетики имеет большое практич. значение, поскольку уменьшение поляризации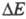 при заданной плотности тока позволяет существенно повысить кпд использования электрохим. систем. Электрохимическая кинетика является теоретич. основой электрохимической защиты металлов от коррозии.
при заданной плотности тока позволяет существенно повысить кпд использования электрохим. систем. Электрохимическая кинетика является теоретич. основой электрохимической защиты металлов от коррозии.
Поскольку электродные процессы являются гетерогенными и состоят из ряда последоват. стадий, общая поляризация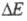 определяется совокупностью поляризаций
определяется совокупностью поляризаций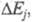 соответствующих отд. стадиям. Стадия, дающая наиб. вклад в суммарную величину
соответствующих отд. стадиям. Стадия, дающая наиб. вклад в суммарную величину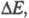 является лимитирующей, она определяет вид поляризац. характеристики. Чтобы определить лимитирующую стадию, сравнивают закономерности исследуемого электродного процесса с закономерностями, характерными для разл. стадий. Определение лимитирующей стадии позволяет, меняя условия, изменить скорость электродного процесса в нужном направлении.
является лимитирующей, она определяет вид поляризац. характеристики. Чтобы определить лимитирующую стадию, сравнивают закономерности исследуемого электродного процесса с закономерностями, характерными для разл. стадий. Определение лимитирующей стадии позволяет, меняя условия, изменить скорость электродного процесса в нужном направлении.
Во всех без исключения электродных процессах имеют место стадия массопереноса реагирующих в-в (к пов-сти электрода или от его пов-сти в объем) и стадия разряда- ионизации, связанная с переходом заряженных частиц через границу раздела фаз. Но если стадия массопереноса присуща любым гетерогенным процессам, то стадия разряда - ионизации является специфич. электрохим. стадией. По этой причине оформление электрохимической кинетики в самостоят. раздел теоретич. электрохимии связывают с разработкой теории замедленного разряда, описывающей кинетич. закономерности стадии разряда - ионизации (М. Фольмер, Т. Эрдей-Груз, А. Н. Фрумкин, 1930-33). Согласно этой теории, для электродного процесса типа Ох + ne-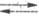 Red поляризац. характеристика описывается ур-нием:
Red поляризац. характеристика описывается ур-нием:
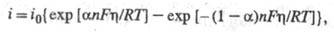
где Т - абс. т-ра; F - число Фарадея; R - газовая постоянная;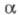 - коэф. переноса
- коэф. переноса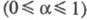 ; i0 - плотн. тока обмена, к-рая обусловлена константой скорости стадии разряда - ионизации, строением двойного электрич. слоя, зарядовыми числами частиц Ох и Red и их энергиями адсорбции на данном электроде. При учете стадии массопереноса ур-ние принимает вид:
; i0 - плотн. тока обмена, к-рая обусловлена константой скорости стадии разряда - ионизации, строением двойного электрич. слоя, зарядовыми числами частиц Ох и Red и их энергиями адсорбции на данном электроде. При учете стадии массопереноса ур-ние принимает вид:
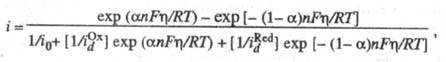
где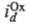 и
и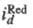 -т.наз. предельные диффузионные токи, характеризующие максимально возможную скорость массопереноса частиц Ох и Red (см. Диффузионный ток). Эта скорость зависит от коэф. диффузии частиц, геометрии электрода и условий перемешивания р-ра. В учебных пособиях по электрохимической кинетике можно найти ур-ния функциональной зависимости
-т.наз. предельные диффузионные токи, характеризующие максимально возможную скорость массопереноса частиц Ох и Red (см. Диффузионный ток). Эта скорость зависит от коэф. диффузии частиц, геометрии электрода и условий перемешивания р-ра. В учебных пособиях по электрохимической кинетике можно найти ур-ния функциональной зависимости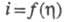 для мн. других случаев, когда скорость электродных процессов определяется др. стадиями - хим. превращениями реагирующих в-в в объеме р-ра и на пов-сти электрода, стадиями образования и роста зародышей новой фазы, после-доват. переносом неск. электронов и др.
для мн. других случаев, когда скорость электродных процессов определяется др. стадиями - хим. превращениями реагирующих в-в в объеме р-ра и на пов-сти электрода, стадиями образования и роста зародышей новой фазы, после-доват. переносом неск. электронов и др.
Для изучения электрохимической кинетики используют методы, позволяющие регистрировать зависимости i от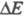 в разл. условиях (разновидности метода полярографии, метод вращающегося дискового электрода и др.), а также разл. релаксационные методы, основанные на анализе временных зависимостей i при заданном
в разл. условиях (разновидности метода полярографии, метод вращающегося дискового электрода и др.), а также разл. релаксационные методы, основанные на анализе временных зависимостей i при заданном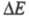 (или
(или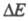 при заданном i). Кроме того, для изучения кинетики и механизма сложных (многостадийных) электродных процессов применяют совокупность аналит. методов, позволяющих регистрировать возникновение и изменение во времени концентраций промежут. в-в и продуктов электролиза (электроаналит. методы; вращающийся дисковый электрод с кольцом; ИК и УФ спектроскопия; метод изотопных индикаторов, хроматография, ЭПР и др.). Используют также метод компьютерного моделирования, позволяющий дать оптимальное описание опытных зависимостей i от
при заданном i). Кроме того, для изучения кинетики и механизма сложных (многостадийных) электродных процессов применяют совокупность аналит. методов, позволяющих регистрировать возникновение и изменение во времени концентраций промежут. в-в и продуктов электролиза (электроаналит. методы; вращающийся дисковый электрод с кольцом; ИК и УФ спектроскопия; метод изотопных индикаторов, хроматография, ЭПР и др.). Используют также метод компьютерного моделирования, позволяющий дать оптимальное описание опытных зависимостей i от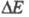 путем подбора кинетич. параметров отд. стадий электродного процесса.
путем подбора кинетич. параметров отд. стадий электродного процесса.
Лит.. Дамаский Б.Б., Петрий О. А., Введение в электрохимическую кинетику, 2 изд., М., 1983.
Б. Б. Дамаскин.
