Электролиз
ЭЛЕКТРОЛИЗ, совокупность электрохим. окислит.-восстановит. процессов, происходящих при прохождении электрич. тока через электролит с погруженными в него электродами. На катоде катионы восстанавливаются в ионы более низкой степени окисления или в атомы, напр.: Fe3+ + e Fe2+, Сu2+ + 2е
Fe2+, Сu2+ + 2е Сu (е - электрон). Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или реагировать с продуктами катодного процесса, к-рые рассматриваются в этом случае как промежут. в-ва электролиза. На аноде происходит окисление ионов или молекул, поступающих из объема электролита или принадлежащих материалу анода; в последнем случае анод растворяется или окисляется (см. Анодное растворение). Напр.:
Сu (е - электрон). Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или реагировать с продуктами катодного процесса, к-рые рассматриваются в этом случае как промежут. в-ва электролиза. На аноде происходит окисление ионов или молекул, поступающих из объема электролита или принадлежащих материалу анода; в последнем случае анод растворяется или окисляется (см. Анодное растворение). Напр.:
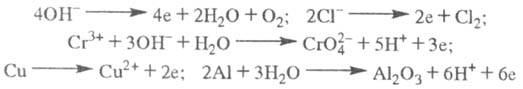
Электролиз включает два процесса: миграцию реагирующих частиц под действием электрич. поля к пов-сти электрода и переход заряда с частицы на электрод или с электрода на частицу. Миграция ионов определяется их подвижностью и числами переноса (см. Электропроводность электролитов}. Процесс переноса неск. электрич. зарядов осуществляется, как правило, в виде последовательности одноэлектронных р-ций, т. е. постадийно, с образованием промежут. частиц (ионов или радикалов), к-рые иногда существуют нек-рое время на электроде в адсорбир. состоянии.
Скорости электродных р-ций зависят от состава и концентрации электролита, материала электродов, электродного потенциала, т-ры, гидродинамич. условий (см. Электрохимическая кинетика). Мерой скорости служит плотность тока -кол-во переносимых электрич. зарядов через единицу площади пов-сти электрода в единицу времени. Кол-во образующихся при электролизе продуктов определяется Фарадея законами. Дня выделения 1 грамм-эквивалента в-ва на электроде необходимо кол-во электричества, равное 26,8 А* ч. Если на каждом из электродов одновременно образуется неск. продуктов в результате ряда электрохим. р-ций, доля тока (в %), идущая на образование продукта одной из р-ций, наз. выходом данного продукта по току.
В электродном процессе участвуют в-ва, требующие для переноса заряда наименьшего электрич. потенциала; это м. б. не те в-ва, к-рые обусловливают перенос электричества в объеме р-ра. Напр., при электролизе водного р-ра NaCl в миграции участвуют ионы Na+ и Сl+, однако на твердых катодах ионы Na+ не разряжаются, а протекает энергетически более выгодный процесс разряда протонированных молекул воды: Н3О+ + е --> 1/2H2 + Н2О.
Применение электролиза. Получение целевых продуктов путем электролиза позволяет сравнительно просто (регулируя силу тока) управлять скоростью и направленностью процесса, благодаря чему можно осуществлять процессы как в самых "мягких", так и в предельно "жестких" условиях окисления или восстановления, получая сильнейшие окислители и восстановители. Путем электролиза производят Н2 и О2 из воды, С12 из водных р-ров NaCl, F2 из расплава KF в KH2F3.
Гидроэлектрометаллургия - важная отрасль металлургии цветных металлов (Сu, Bi, Sb, Sn, Pb, Ni, Co, Cd, Zn); она применяется также для получения благородных и рассеянных металлов, Мn, Сr. Электролиз используют непосредственно для катодного выделения металла после того, как он переведен из руды в р-р, а р-р подвергнут очистке. Такой процесс наз. электроэкстракцией. Электролиз применяют также для очистки металла - электролитич. рафинирования (электрорафинирование). Этот процесс состоит в анодном растворении загрязненного металла и в последующем его катодном осаждении. Рафинирование и электроэкстракцию проводят с жидкими электродами из ртути и амальгам (амальгамная металлургия) и с электродами из твердых металлов.
Электролиз расплавов электролитов - важный способ произ-ва мн. металлов. Так, напр., алюминий-сырец получают электролизом криолит-глиноземного расплава (Na3AlF6 + A12O3), очистку сырца осуществляют электролитич. рафинированием. При этом анодом служит расплав А1, содержащий до 35% Сu (для утяжеления) и потому находящийся на дне ванны электролизера. Средний жидкий слой ванны содержит ВаС12, A1F3 и NaF, a верхний - расплавленный рафинир. А1 и служит катодом.
Электролиз расплава хлорида магния или обезвоженного карналлита - наиб. распространенный способ получения Mg. В пром. масштабе электролиз расплавов используют для получения щелочных и щел.-зем. металлов, Be, Ti, W, Mo, Zr, U и др.
К электролитич. способам получения металлов относят также восстановление ионов металла другим, более электро-отрицат. металлом. Выделение металлов восстановлением их водородом также часто включает стадии электролиза - электрохим. ионизацию водорода и осаждение ионов металла за счет освобождающихся при этом электронов. Важную роль играют процессы совместного выделения или растворения неск. металлов, совместного выделения металлов и мол. водорода на катоде и адсорбции компонентов р-ра на электродах. Электролиз используют для приготовления металлич. порошков с заданными св-вами.
Другие важнейшие применения электролиза- гальванотехника, электросинтез, электрохимическая обработка металлов, защита от коррозии (см. Электрохимическая защита).
Электролизеры. Конструкция пром. аппаратов для проведения электролитич. процессов определяется характером процесса. В гидрометаллургии и гальванотехнике используют преим. т. наз. ящичные электролизеры, представляющие собой открытую емкость с электролитом, в к-рой размещают чередующиеся катоды и аноды, соединенные соотв. с отрицат. и положит. полюсами источника постоянного тока. Для изготовления анодов применяют графит, углеграфитовые материалы, платину, оксиды железа, свинца, никеля, свинец и его сплавы; используют малоизнашивающиеся титановые аноды с активным покрытием из смеси оксидов рутения и титана (оксидные рутениево-титановые аноды, или ОРТА), а также из платины и ее сплавов. Для катодов в большинстве электролизеров применяют сталь, в т. ч. с разл. защитными покрытиями с учетом агрессивности электролита и продуктов электролиза, т-ры и др. условий процесса. Нек-рые электролизеры работают в условиях высоких давлений, напр, разложение воды ведется под давлением до 4 МПа; разрабатываются электролизеры и для более высоких давлений. В совр. электролизерах широко применяют пластич. массы, стекло и стеклопластики, керамику.
Во мн. электрохим. произ-вах требуется разделение катодного и анодного пространств, к-рое осуществляют с помощью диафрагм, проницаемых для ионов, но затрудняющих мех. смешение и диффузию. При этом достигается разделение жидких и газообразных продуктов, образующихся на электродах или в объеме р-ра, предотвращается участие исходных, промежут. и конечных продуктов электролиза в р-циях на электроде противоположного знака и в приэлектродном пространстве. В пористых диафрагмах через микропоры переносятся как катионы, так и анионы в кол-вах, соответствующих числам переноса. В ионообменных диафрагмах (мембранах) происходит перенос либо только катионов, либо анионов, в зависимости от природы входящих в их состав ионогенных групп. При синтезе сильных окислителей используют обычно без-диафрагменные электролизеры, но в р-р электролита добавляют К2Сr2О7. В процессе электролиза на катоде образуется пористая хромит-хроматная пленка, выполняющая ф-ции диафрагмы. При получении хлора используют катод в виде стальной сетки, на к-рую наносят слой асбеста, играющий роль диафрагмы. В процессе электролиза рассол подают в анодную камеру, а из анодной камеры выводят р-р NaOH.
Электролизер, применяемый для получения магния, алюминия, щелочных и щел.-зем. металлов, представляет собой футерованную огнеупорным материалом ванну, на дне к-рой находится расплавленный металл, служащий катодом, аноды же в виде блоков располагают над слоем жидкого металла. В процессах мембранного получения хлора, в электросинтезе используют электролизеры фильтр-прессного типа, собранные из отд. рам, между к-рыми помещены ионообменные мембраны.
По характеру подключения к источнику питания различают монополярные и биполярные электролизеры (рис.). Монополярный электролизер состоит из одной электролитич. ячейки с электродами одной полярности, каждый из к-рых может состоять из неск. элементов, включенных параллельно в цепь тока. Биполярный электролизер имеет большое число ячеек (до 100-160), включенных последовательно в цепь тока, причем каждый электрод, за исключением двух крайних, работает одной стороной как катод, а другой как анод. Монополярные электролизеры обычно рассчитаны на большой ток и малые напряжения, биполярные - на сравнительно небольшой ток и высокие напряжения. Совр. электролизеры допускают высокую токовую нагрузку: монополярные до 400-500 кА, биполярные эквивалентную 1600 кА.
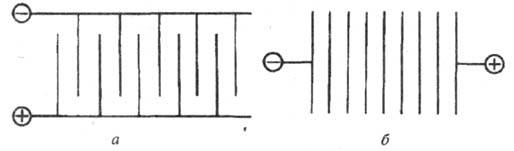
Схема подключения к источнику внеш. тока монополярного (а)и биполярного (б)электролизеров.
Лит.: Фиошин М.Я., Павлов В. Н., Электролиз в неорганической химии, М., 1976; Зимин В. М., Камарьян Г. М., Мазанко А.Ф., Хлорные электролизеры, М., 1984; Фиошин М.Я., Смирнова М. Г., Электрохимические системы в синтезе химических продуктов, М., 1985; Мазанко А.Ф., Камарьян Г.М., Помашин О.П., Промышленный мембранный электролиз, М., 1989; см. также лит. к ст. Электросинтез, Электрохимическая обработка металлов.
А. П. Тамилов.
