Фарадея законы
ФАРАДЕЯ ЗАКОНЫ, основные законы электролиза, отражающие общий закон сохранения в-ва в условиях протекания злектрохим. р-ции. Установлены M. Фарадеем в 1833-34. Согласно 1-му закону, масса в-ва т, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролиза t, т. е. кол-ву пропущенного электричества Q = It (предполагается, что I не зависит от t; в противном случае масса т пропорциональна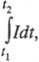 где t1 и t2 - моменты включения и выключения тока). Согласно 2-му закону, для разных электродных процессов при одинаковом кол-ве пропущенного электричества Q массы прореагировавших в-в относятся друг к другу так же, как эквиваленты химические этих в-в. Оба Фарадея закона объединяются одним ур-нием:
где t1 и t2 - моменты включения и выключения тока). Согласно 2-му закону, для разных электродных процессов при одинаковом кол-ве пропущенного электричества Q массы прореагировавших в-в относятся друг к другу так же, как эквиваленты химические этих в-в. Оба Фарадея закона объединяются одним ур-нием:
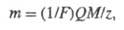
где M - мол. м. в-ва, участвующего в электролизе, z - число элементарных зарядов, соответствующее превращению одной молекулы этого в-ва, 1/F- коэф. пропорциональности, общий для всех в-в, F - Фарадея постоянная, равная 96484,56 Кл/моль.
Фарадея законы относятся к числу строгих законов, но в ряде случаев могут наблюдаться кажущиеся отклонения от них, вызываемые след. причинами: 1) в нестационарных условиях электролиза часть электричества затрачивается на заряжение двойного электрического слоя; 2) если электролит обладает электронной проводимостью (напр., р-р металлич. Na в жидком аммиаке), то часть тока через электролит переносят электроны, а не ионы, и соответствующее кол-во электричества не участвует в процессе электролиза; 3) наряду с основным процессом электролиза, напр, образованием металлич. Zn по р-ции Zn2+ + 2е Zn, часть тока может затрачиваться на протекание параллельных электрохим. р-ций, напр.: 2H3O+ + 2е = H2 + 2H2O; O2 + 4е + 4H3O+ = 6H2O. Системы, в к-рых полностью исключены указанные причины кажущихся отклонений от Фарадея законов, получили назв. кулонометров; их использование позволяет по кол-ву образовавшихся продуктов электролиза точно определить кол-во пропущенного электричества. В кулонометрах обычно применяют электрохим. р-ции Ag+ + е = Ag или 3I- = I3- + 2е.
Zn, часть тока может затрачиваться на протекание параллельных электрохим. р-ций, напр.: 2H3O+ + 2е = H2 + 2H2O; O2 + 4е + 4H3O+ = 6H2O. Системы, в к-рых полностью исключены указанные причины кажущихся отклонений от Фарадея законов, получили назв. кулонометров; их использование позволяет по кол-ву образовавшихся продуктов электролиза точно определить кол-во пропущенного электричества. В кулонометрах обычно применяют электрохим. р-ции Ag+ + е = Ag или 3I- = I3- + 2е.
Фарадея законы сыграли важную роль в понимании природы хим. связи и развития атомно-молекулярной теории. Их используют при выводе всех ур-ний, описывающих электрохим. превращения B-B на границах раздела проводников 1-го и 2-го рода (см. Электрохимическая кинетика). Практич. применение Фарадея законы находят в кулонометрии, а также при определении выхода р-ции по току, т.е. отношения теоретич. кол-ва электричества, рассчитанного на основе Фарадея законов, к кол-ву электричества, реально затраченному на получение данного в-ва в процессе электролиза.
Лит.: Антропов Л.И., Теоретическая электрохимия, 4 изд., M., 1984, с. 278-86. Б. Б. Дамаскин.
