Растворение
РАСТВОРЕНИЕ твердых тел, гетерогенное физ.-хим. взаимод. твердого тела и жидкости, сопровождающееся переходом твердой фазы в р-р; один из осн. процессов хим. технологии. Растворение следует отличать от экстрагирования, при к-ром контактирующие с р-ром твердые частицы состоят из двух или более р-римых и инертных твердых фаз, а растворение носит избират. характер (см. также Выщелачивание).
Различают физическое, химическое и электрохимическое растворение. При физическом растворении переход в р-р в-ва не сопровождается изменением его хим. состава; в-во можно выделить в твердом состоянии с помощью выпаривания и кристаллизации. При химическом растворении переход в-ва в р-р сопровождается хим. р-цией; исходное в-во нельзя выделить из р-ра в твердом состоянии физ. методами (примеры-растворение металлов или их оксидов в к-тах, растворение фосфоритов либо апатитов в сернокислотном р-ре с получением Н3РО4 и др.). Электрохимическое растворение протекает в условиях, когда процессу сопутствует перенос электрич. зарядов. Наиб. изучены закономерности и практика растворения твердых в-в с ионной кристаллич. решеткой (гл. обр. соли), к-рым в осн. посвящена данная статья.
Физико-химические основы процесса
Растворение сопровождается поглощением или выделением теплоты. Тепловой эффект растворения находят по ур-нию: DHр = U — — DHг(с), где 17- энергия кристаллич. решетки растворяемой соли, DHг(с) - теплота гидратации (сольватации) перешедших в р-р ионов соли. При U > DHг(с) и DHр > 0 процесс эндотермичен; при U < DHг(с) и DHр > 0 процесс экзотермичен. Условия самопроизвольного протекания процесса определяются знаком величины DG, к-рую вычисляют по выражению: DG = DHр — TDS, где Т-абс. т-ра; DS-изменение энтропии. При DG < 0 вероятно растворение, при DG > 0 вероятен обратный процесс-кристаллизация. Расчет может дать положит. либо отрицат. результат (отсутствие или наличие растворимости).
При нек-рой концентрации, наз. концентрацией насыщения сн, между твердым телом и жидкостью устанавливается равновесие. При нем хим. потенциал в-ва в р-ре становится равным хим. потенциалу того же в-ва в твердом состоянии. Концентрация сн не зависит от давления, однако в значит. степени определяется т-рой, с увеличением к-рой р-римость возрастает. Последняя оказывает сильное влияние на кинетику растворения. С увеличением р-римости возрастает разность концентраций (движущая сила процесса) и растворение ускоряется (см. также Растворы).
Физическое растворение может протекать по диффузионному, кине-тич. или смешанному механизму (см. Массообмен). Рассмотрим наиб. распространенный диффузионный механизм. При растворении на пов-сти растворяющегося тела возникает диффузионный пограничный слой, в пределах к-рого концентрация изменяется от сн на пов-сти тела до концентрации с в осн. массе р-ра. При погружении тела в неподвижную жидкость в пределах диффузионного слоя возникает движение жидкости, побуждаемое разностью плотностей ее и тела в слое и вне его (естеств. конвекция). При погружении тела в движущуюся жидкость в пределах диффузионного слоя также возникает движение, скорость к-рого снижается по мере приближения к пов-сти тела (вынужденная конвекция, ускоряемая перемешиванием). При этом толщина слоя зависит от его диффузионных и гидродинамич. параметров и уменьшается с увеличением числа Рейнольдса Re = ud/v (u-скорость обтекания жидкостью объекта растворения, d-eгo размер, v-кинематич. вязкость жидкости).
Осн. закон кинетики .диффузионного растворения: —dM/dt = = kF(cн — с), где М-масса растворяющегося в-ва, t-время, k-коэф. массоотдачи, F-площадь пов-сти растворения. Параметр k определяется ур-ниями в обобщенных переменных (табл.; см. Подобия теория).
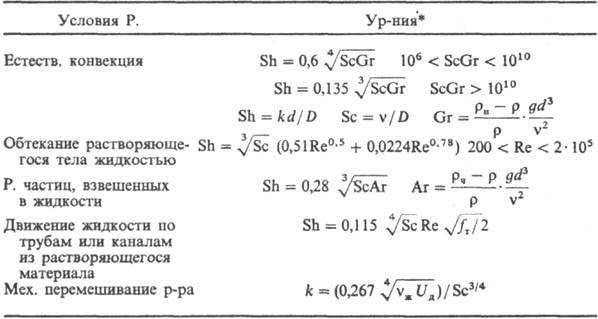
* Обозначения: D-коэф. диффузии; g- ускорение своб. падения; r-плотн. р-ра; rн-плотн. насыщ. р-ра; rч-плотн. твердых частиц; fт - коэф. трения; Uд = = N/rVж-среднее значение диссипации энергии в единице массы перемешиваемой жидкости; N = x r w3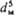 - мощность, затрачиваемая на перемешивание; Vж- объем жидкости в аппарате; w-частота вращения мешалки; dм- диаметр окружности, описываемой мешалкой; 4-коэф. сопротивления вращению мешалки.
- мощность, затрачиваемая на перемешивание; Vж- объем жидкости в аппарате; w-частота вращения мешалки; dм- диаметр окружности, описываемой мешалкой; 4-коэф. сопротивления вращению мешалки.
Химическое растворение может протекать без образования или с образованием новой фазы.
Растворение без образования новой фазы (продукты р-ции растворены в жидкости). Скорость процесса находят из выражения:
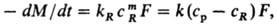
где kR-константа скорости р-ции на пов-сти растворения; ср, сR-концентрации реагента (к-та, щелочь) в осн. массе р-ра и на пов-сти растворения; m-стехиометрич. коэффициент. При т = 1 имеем:
-dM/dt = Fcp/(1/kR+1/k).
Аналогично физическому растворению в данном случае также различают диффузионный, кинетич. и смешанный механизмы.
Растворение с образованием новой твердой фазы. Возможно неск. вариантов процесса.
1) Твердый продукт р-ции немедленно удаляется с пов-сти растворения; при этом скорость процесса остается постоянной (при F = const и с = const).
2) Твердый продукт образует пленку с постоянной по толщине пористостью, плотно связанную с исходным твердым материалом. По мере протекания процесса толщина пленки возрастает, а скорость процесса снижается. Анализ кинетики растворения сферич. частиц (наиб. распространенный случай) в описанных условиях приводит к выражению:
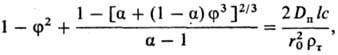
где f = r/r0; a = m'(rт/rп); r0, r-начальный и текущий радиусы растворяющейся сферы из исходного в-ва; rт, rп-плотн. в-ва и продуктов р-ции; Dп-коэф. диффузии в-ва сквозь пленку продуктов; l, m'-стехиометрич. коэф. пересчета от исходного в-ва к реагенту и от продуктов р-ции к растворяющемуся в-ву.
3) Образующаяся твердая фаза кристаллизуется в р-ре, что обусловлено его пересыщением, и осаждается на пов-сти растворения. Ее экранирование тем значительнее, чем выше концентрация твердых частиц в р-ре.
Растворение с образованием газообразной фазы встречается особенно часто (растворение металлов в к-тах и разложение ими карбонатов или сульфитов с выделением Н2, СО2 или SO2). Газообразные продукты оказывают сильное, иногда определяющее влияние на химическое растворение: изолируют от жидкого реагента пов-сть р-ции и способствуют хорошему перемешиванию р-ра вблизи этой пов-сти благодаря выделению газовых пузырьков. Интенсивность пузырькового режима, число пузырьков и частота их образования зависят от концентрации реагента. С ее увеличением возрастает константа скорости kR. При определенной концентрации реагента, наз. критической, константа достигает максимума, а при дальнейшем увеличении уменьшается.
Для мн. объектов растворение в условиях газовыделения протекает в диффузионной области; закономерности изменения конста.нты kR объясняются следующим образом: с возрастанием концентрации реагента интенсифицируется пузырьковый режим, что способствует турбулизации пограничного слоя и уменьшению толщины диффузионного слоя, т.е. интенсификации транспорта реагента к пов-сти растворения. Одновременно ускоряется экранирование пов-сти (изоляция ее от жидкой среды), вследствие чего по достижении критич. концентрации величина kR начинает снижаться. Помимо концентрации реагента на константу скорости влияют вязкость жидкости (с ее увеличением kR уменьшается) и давление в системе; при возрастании последнего рост пузырьков и общая интенсивность пузырькового режима снижаются, что также приводит к уменьшению kR.
Опытные данные по кинетике растворения ряда объектов обобщены критериальными ур-ниями, к-рые применимы к концентрациям, не превышающим критические:
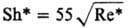 Sc < 300
Sc < 300 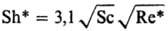 Sc>300 10-3
Sc>300 10-3
Sh* = (kR d)/DR Sc* = (lqR d)/(rruж)
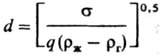 Sс=uж/DR,
Sс=uж/DR,
где s-поверхностное натяжение жидкости; DR-коэф. диффузии реагента; rж, rг-плотн. жидкости и газа; qR-плотн. потока реагента к пов-сти растворения; l-стехиометрич. коэффициент. Обобщение выполнено с учетом результатов экспериментов по растворению Mg, Мn, СаСО3, СuСО3 · Сu(ОН)2 в к-тах (НС1, HNO3, H2SO4). Известно немало случаев, когда растворение металлов и сплавов протекает в кинетич. области; так, А1 и его сплавы раств. в р-рах щелочей, а константа скорости растворения удовлетворяет ур-нию: kR = k0e-E/RT (Е-энергия активации, R-газовая постоянная, Т-абс. т-ра).
Закономерности растворения техн. металлов и их сплавов связаны с электрохим. явлениями (см. Коррозия металлов, Электрохимическая кинетика).
Способы организации и аппаратурное оформление
Схемы процесса. Пром. реализация растворения, проводимого в аппаратах-растворителях, связана с определенной схемой взаимод. твердой и жидкой фаз: замкнутый периодич. процесс (напр., в аппарате с мешалкой); прямоточное или противоточное растворение, при к-ром фазы движутся соотв. в одном направлении либо в противоположных направлениях; периодич. растворение в слое растворяющихся частиц (жидкость фильтруется через неподвижный стационарный слой). В крупнотоннажных произ-вах наиб. распространены прямоточная и противоточная схемы. При прямотоке пов-сть растворения и движущая сила (сн — с) одновременно уменьшаются, что приводит к замедлению процесса. При противотоке уменьшение пов-сти растворения сопровождается увеличением разности концентраций, а скорость растворения более постоянна. Выбор схемы растворения зависит также и от др. факторов, напр. от размера частиц растворяющегося в-ва. Так, при растворении полидисперсной смеси частиц в противоточном аппарате трудно избежать выноса за его пределы мелкой фракции вместе с жидкостью.
В практике растворения широко применяют комбинир. схемы, комплектуемые из ряда аппаратов. Так, каждый аппарат в отдельности работает по принципу прямотока, а вместе соединены в противоточную схему. Растворению обычно предшествует измельчение твердого материала, что способствует ускорению процесса, но требует больших энергетич. затрат и затрудняет фильтрац. очистку полученного р-ра. Размер частиц, поступающих на растворение, находят оптимизацией его самого и всей совокупности сопутствующих процессов.
При галургич. переработке минер., сырья важную роль играет растворение многокомпонентных солевых систем. Напр., в основе получения КС1 из сильвинита лежит частичное растворение NaCl и почти полное растворение KCl в горячих щелоках с последующим выделением из р-ра готового продукта при охлаждении. Кинетика растворения смеси из п компонентов определяется совместным решением (обычно на ЭВМ) системы ур-ний:
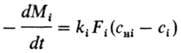
Cнi=fc(с1, с2,..., сn)
Fi=fF(Mi) i=1,2,...,n
и ур-ния материального баланса типа
Mi0-Mi = W(ci0-ci),
где Mi0-начальная масса i-го компонента; ci0-начальная концентрация р-ра; W-его объем.
Аппаратура. При периодич. процессе в одном и том же аппарате выполняют ряд последоват. операций: дозировку компонентов р-ра, заполнение рабочего объема, подогрев жидкости до заданной т-ры, собственно растворение, отделение р-ра от нерастворимого остатка, их выгрузку, подготовку к след. циклу. К оборудованию периодич. действия, используемому в малотоннажных произ-вах и при большом ассортименте растворяемых в-в, относятся аппараты с мех. перемешиванием и со стационарным слоем растворяющихся твердых частиц. В первом случае применяют перемешивающие приспособления разл. типов, частота вращения к-рых должна быть достаточна для создания гидродинамич. силы, способной привести частицы во взвешенное состояние (см. также Перемешивание). Во втором случае р-р фильтруется сквозь слой растворяющихся и инертных частиц, а скорость фильтрования определяет кинетику растворения.
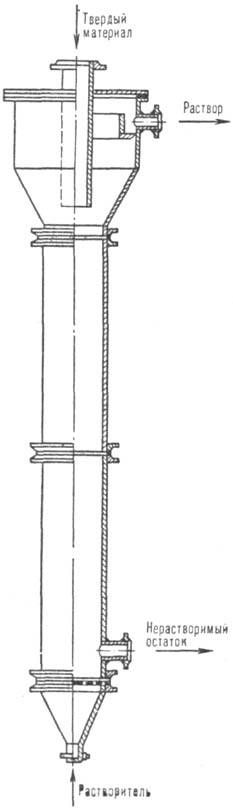
Рис. 1. Колонный аппарат для растворе- ния в псевдоожиженном слое.
Аппараты непрерывного действия используют для растворения больших масс материала. Каждая стадия осуществляется в отдельном аппарате. Пром. значение имеют аппараты: с псевдоожиженным слоем растворяющихся частиц; сочетающие растворение с гидравлич. транспортом целевых продуктов; с транспортирующими и перемешивающимися устройствами; с движущимся слоем твердой фазы.
На рис. 1 представлен аппарат с псевдоожиженным слоем, предназначенный для растворения, напр., галитовых отходов (размер частиц 0,5-5,0 мм) калийных предприятий. Скорость движения растворяющего рассола должна превышать скорость псевдоожижения крупных частиц.
Трубчатый растворитель (рис. 2) состоит из ряда последовательно соединенных вертикальных труб, через к-рые насосом перекачивается суспензия, предварительно подготовленная в аппарате с мешалкой 2. Скорость движения жидкости должна превышать скорость осаждения самых крупных частиц во избежание закупорки труб. В случае аварийной остановки насоса жидкость, содержащая и твердую фазу, спускается в горизонтальный корытный аппарат с мешалкой 7.
К числу аппаратов с транспортирующими и перемешивающими устройствами относится шнековый растворитель (рис. 3). Сварной корпус корытообразной формы снабжен шнеком для перемешивания твердого материала и наклонным ковшовым элеватором для выгрузки нерастворившегося остатка. Уменьшение продольного перемешивания достигается секционированием аппарата спец. перегородками. Растворяющий реагент движется к элеватору (прямоток) или в противоположном направлении (противоток). В перспективе предполагается использование вертикальных противоточных колонных аппаратов с движущимся слоем р-римого в-ва.
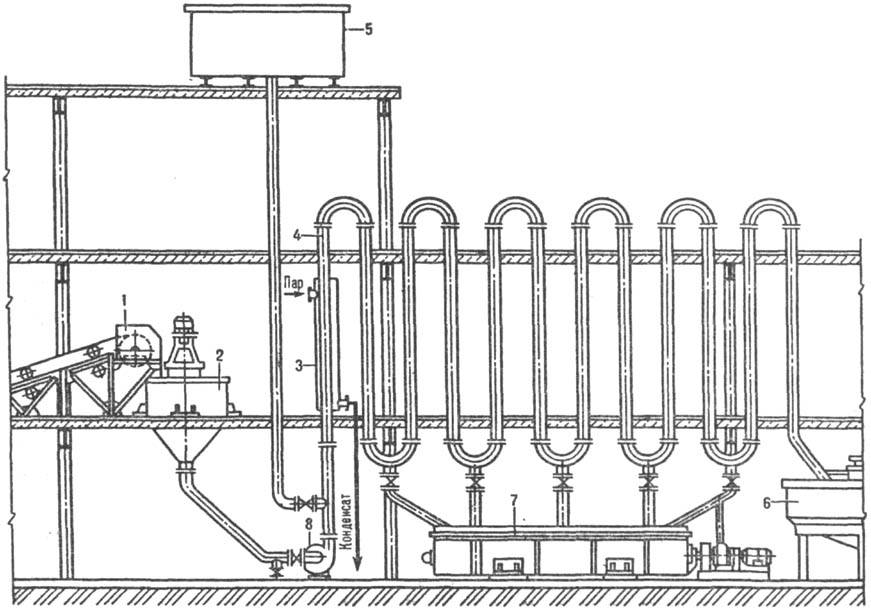
Рис. 2. Трубчатый растворитель: 1 -ленточный транспортер для твердого материала; 2, 7-аппараты с мешалками; 3-паровая рубашка; 4-вертикальные трубы; 5-бак с водой для промывки труб; 6-сгуститель; 8-насос.
Интенсификация процесса. Скорость растворения, как правило, возрастает с увеличением т-ры, однако р-р можно нагревать до определенного предела, обусловленного пределом кипения жидкости и стоимостью тепловой энергии. В практике растворения используют методы, основанные на обтекании твердых частиц жидкостью, а также на систематич. обновлении пов-сти растворения: интенсивное перемешивание мех. мешалками и др. устройствами; наложение поля колебаний (от низкочастотных до ультразвуковых); сочетание растворения и измельчения в одном аппарате; применение электрич. разрядов в жидкости. Два последних метода обеспечивают высокую степень интенсификации растворения и, кроме того, эффективны, если твердые частицы первоначально покрыты экранирующими инертными пленками или примесями.
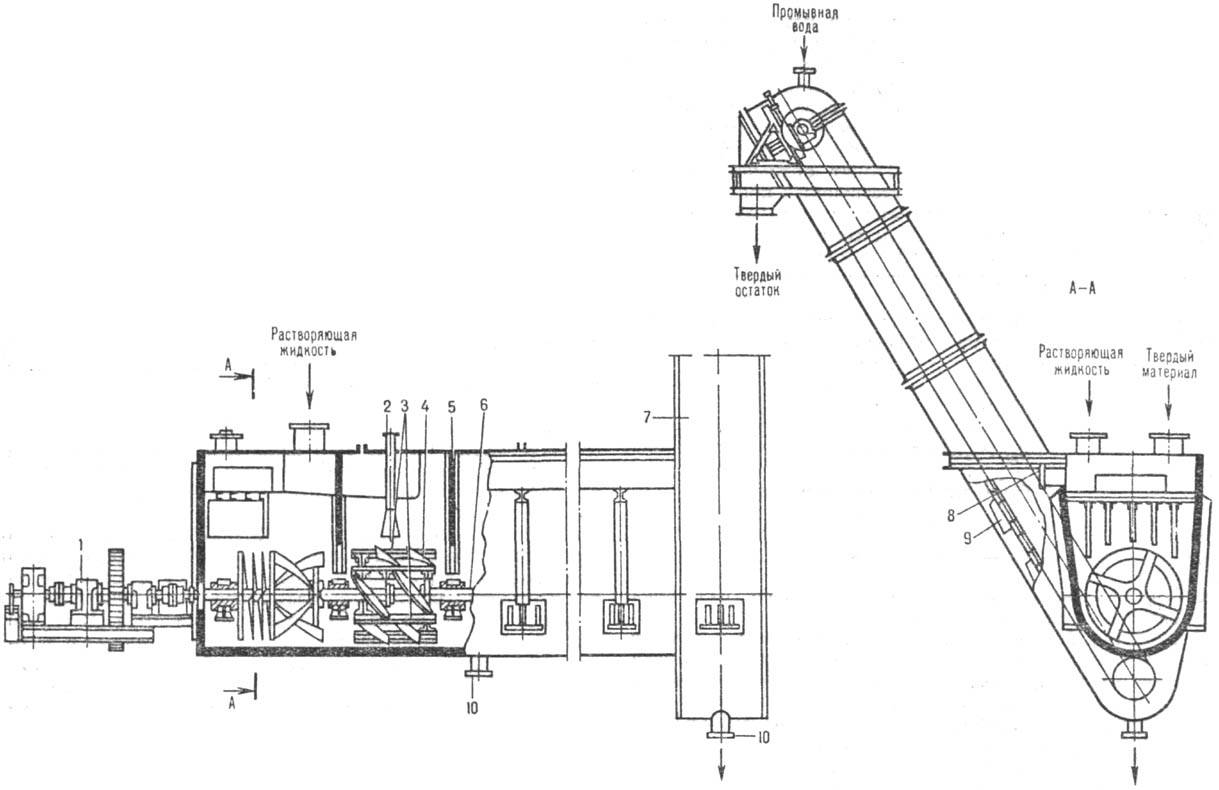
Рис. 3. Шнековый растворитель: 1 -привод; 2-сопло для пара; 3-скребки для перемешивания материала в пределах каждой секции; 4, 6-лопасть и вал мешалки (шнека); 5 - перегородка; 7-элеватор; 8-штуцер для отвода р-ра; 9-ковш; 10-штуцеры для аварийного опорожнения.
Растворение широко используют в хим. и смежных отраслях промети для получения р-ров с последующей их переработкой (см. Галургия), отделения р-римых в-в от сопутствующих инертных примесей (напр., в произ-вах минер. солей и удобрений), обработки р-римых материалов, в т.ч. металлов, с целью придания им определенных размера и формы (т. наз. химическое фрезерование), создания полостей большого объема в соляных толщах с целью хранения в них газов и жидкостей.
Лит.: Здановский А.Б., Кинетика растворения природных солей в условиях вынужденной конвекции, Л., 1956; Аксельруд Г. А., Мол чанов А. Д., Растворение твердых веществ, М., 1977; Галургия, под ред. И. Д. Соколова, Л., 1983; Аксельруд Г. А., Гумницкий Я. М., Дубинин А. И., "Теоретич. основы хим. технологии", 1989, т. 23, № 1, с. 28-33; К а раж ан о в Н. А., Основы кинетики растворения солей, А.-А., 1989. Г. А. Аксельруд.
