Кристаллизация
КРИСТАЛЛИЗАЦИЯ, переход в-ва из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое, а также из одного кристаллич. состояния в другое (рекристаллизация, или вторичная кристаллизация); фазовый переход первого рода. Кристаллизация из жидкой или газовой фазы-экзотермич. процесс, при к-ром выделяется теплота фазового перехода, или теплота кристаллизации; при этом изменение энтропии в большинстве случаев составляет [в Дж/(моль.К)]: для простых в-в 5-12, для неорг. соед. 20 - 30, для орг. соед. 40-60. Рекристаллизация может протекать с выделением либо поглощением теплоты. В пром-сти и лаб. практике кристаллизацию используют для получения продуктов с заданными составом, содержанием примесей, размерами, формой и дефектностью кристаллов (см. Дефекты, Кристаллическая структура. Кристаллы), а также для фракционного разделения смесей (см. Кристаллизационные методы разделения смесей), выращивания монокристаллов и др.Физико-химические основы процесса. Условия, при к-рых возможна кристаллизация, определяются видом диаграммы состояния. Чтобы кристаллизация протекала с конечной скоростью, исходную фазу необходимо переохладить (перегреть), пересытить кристаллизующимся в-вом или внести во внеш. поле, снижающее р-римость кристаллизующейся фазы. В переохлажденной (перегретой) либо пересыщенной фазе происходит зарождение новой фазы - образуются центры кристаллизации, к-рые превращ. в кристаллы и растут, как правило, изменяя форму, содержание примесей и дефектность. Центры кристаллизации возникают гомогенно в объеме начальной фазы и гетерогенно на пов-стях посторонних твердых частиц (первичное зародышеобразование), а также вблизи пов-сти ранее сформировавшихся кристаллов новой фазы (вторичное зародышеобразование). Общее число центров кристаллизации, возникших в единице объема р-ра или расплава в 1 с, или суммарную интенсивность их первичного и вторичного образования, находят по ф-ле:
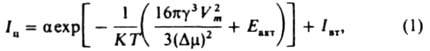
где a-кинетич. коэф. первичного зародышеобразования, к-рый рассматривают в рамках кинетич. теории образования новой фазы; R - газовая постоянная; T - т-ра кристаллизации; у-уд. поверхностная своб. энергия кристаллов; Vт - молярный объем новой фазы; Dm=DHS и S = (Т0-7)/Т0 для расплавов, am=RT1n(S + 1) и S = (c-c0)/c0 для р-ров; DH-энтальпия кристаллизации ; с - концентрация кристаллизующегося в-ва; Т0 и c0 - соотв. т-ра плавления в-ва и концентрация насыщ. р-ра; Eакт - энергия активации перехода молекул из среды в центры кристаллизации; Iат - интенсивность вторичного зародышеобразования в объеме начальной фазы. Для измерения a, Eaкт и Iвт находят зависимость интенсивности образования центров кристаллизации от т-ры, пересыщения и концентрации посторонних твердых частиц. Величина Iи проходит через один или неск. максимумов (рис. 1) с возрастанием переохлаждения (пересыщения) и увеличивается при мех. воздействиях (перемешивание, ультразвук) или под влиянием ионизирующего излучения.
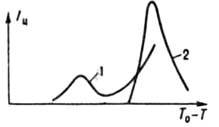
Рис. I Зависимость скорости зародышеобразования от переохлаждения расплава InSb: I расплав массой 16 г перегревался в кварцевом тигле на 15 К выше т-ры плавления в течение 9 мин и затем охлаждался со скоростью 1 град/мин; 2 то же, на 55 К в течение 20 с.
При росте кристаллов сначала кристаллизующееся в-во адсорбируется на пов-сти сформировавшегося кристаллика, а затем встраивается в его кристаллич. решетку: при сильном переохлаждении равновероятно на любом участке пов-сти (нормальный рост), при слабом - слоями тангенциально на ступенях, образованных винтовыми дислокациями или двухмерными зародышами (послойный рост). Если переохлаждение ниже нек-рого значения, наз. пределом морфологич. устойчивости, нормально растущий кристалл повторяет форму (обычно округлую) теплового либо концентрац. поля вокруг него, а послойно растущий кристалл имеет форму многогранника. При превышении указанного предела растут древовидные кристаллы (дендриты).
Количественно рост кристаллов характеризуют линейной скоростью, равной скорости перемещения их пов-сти в нормальном к ней направлении. В пром-сти используют эффективную линейную скорость роста (увеличение в 1 с радиуса шара, объем к-рого равен объему кристалла): Iэфф=bSnехр(Eр/RT), где b - кинетич. коэф. роста (10-5-10-14 м/с), n-параметр роста (обычно 1-3), Ер - энергия активации роста (10-150 кДж/моль). Параметры b, n и Eр находят, измеряя Iэфф при разных т-рах и пересыщениях р-ра или переохлаждениях расплава. С увеличением переохлаждения Iэфф проходит через максимум аналогично Im. Скорость роста может лимитироваться массо- и теплообменом кристаллов со средой (соотв. внешнедиффузионный и теплообменный режимы роста), скоростью хим. взаимод. кристаллизующегося компонента с др. компонентами среды (внешнекинетич. режим) или процессами на пов-сти кристаллов (адсорбционно-кинетич. режим). Во внешнекинетич. режиме Iэфф возрастает с повышением концентраций реагентов и катализаторов, во внешнедиффузионном и теплообменном режимах - с увеличением интенсивности перемешивания, в адсорбционно-кинетич. режиме - с возрастанием поверхностной дефектности кристаллов и уменьшением концентрации ПАВ. При высоких скоростях роста кристаллы приобретают значит. число неравновесных дефектов (вакансий, дислокаций и др.). При превышении предела морфологич. устойчивости в объем кристаллов попадают трехмерные включения среды, замурованные между ветвями дендритов (окклюзия). Состав кристаллов из-за окклюзии приближается к составу среды тем больше, чем выше Iэфф. При своем росте кристаллы захватывают любую присутствующую в среде примесь, причем концентрация захваченной примеси зависит от скорости роста. Если кристаллизация происходит в р-ре и кристаллы после завершения роста продолжают контактировать со средой, то неравновесно захваченная примесь выбрасывается из кристаллов в среду, а их структура совершенствуется (структурная перекристаллизация). Одновременно в перемешиваемой среде при столкновениях кристаллов друг с другом и со стенками кристаллизатора возникают дополнит. структурные дефекты. Поэтому в системе постепенно устанавливается стационарная дефектность кристаллов, к-рая зависит от интенсивности перемешивания. В наиб. распространенном случае образования при кристаллизации множества кристаллов (массовая кристаллизация) выделяющаяся фаза полидисперсна, что обусловлено неодновременностью зарождения кристаллов и флуктуациями их роста. Мелкие кристаллы более р-римы, чем крупные, поэтому при убывающем пересыщении наступает момент, когда среда, оставаясь пересыщенной относительно последних, становитcя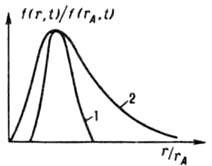
Рис. 2. Функция распределения кристаллов по размерам (обычным r и наиб. вероятным rA)при изотермической (298 К) периодич. кристаллизации из водного р-ра в кристаллизаторе с мешалкой (число Re=104): 1 BaSO4, исходное пересышение S0=500. rA=7.6 мкм; 2 - K2SO4, высаливание метанолом (1.1)rA=1 мкм; t время процесса.
насыщенной относительно мелких кристаллов. С этого момента начинаются их растворение и рост крупных кристаллов (освальдoво созревание), в результате чего средний размер кристаллов возрастает, а их число уменьшается. Одновременно в перемешиваемой среде кристаллы раскалываются при соударениях и через нек-рое время приобретают стационарную дисперсность, определяемую интенсивностью мех. воздействия. Осн. количеств, характеристика массовой кристаллизации - ф-ция распределения кристаллов по размеру f(r,t)=dN/dr, где N - число кристаллов, размер к-рых меньше текущего размера r, в единице объема в момент t. Эта ф-ция часто имеет колоколообразный вид (рис. 2); восходящая ее ветвь чувствительна в осн. к зародышеобразованию, росту, раскалыванию и растворению (при созревании) кристаллов, нисходящая к росту и образованию их агрегатов. Если среднее квадратичное отклонение размера кристаллов от среднего не превышает половины, последнего, упомянутая ф-ция наз. узкой, если превышает - широкой. Изменение ф-ции f(r,t) при кристаллизации описывается ур-нием:
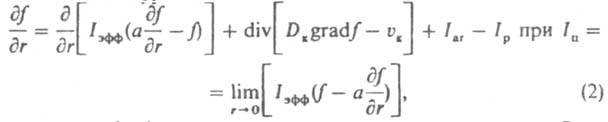
где a - коэф. флуктуации скорости роста кристаллов; Dк и vк - соотв. коэф. диффузии и скорость перемещения кристаллов в среде; Iar и Iр - соотв. интенсивность образования кристаллов данного размера за счет слипания более мелких частиц и раскалывания кристаллов. Система ур-ний материального и теплового балансов, ур-ния (2), а также ур-ния, связывающие размеры и скорость роста кристаллов с их формой, дефектностью и содержанием примесей, - основа моделирования и расчета массовой кристаллизации и выбора оптим. условий ее реализации. Массовую кристаллизацию осуществляют периодически или непрерывно. При периодич. кристаллизации охлаждают расплав или насыщ. р-р (пар), испаряют р-ритель, добавляют высаливающие агенты (см. ниже) или смешивают порции реагентов, образующих продукционные кристаллы. При непрерывной кристаллизации в кристаллизатор вводят потоки расплава, пересыщенного р-ра либо реагентов и непрерывно отводят кристаллич. продукт. При пeриодич. процессе скорость кристаллизации, определяемая по ф-ле:
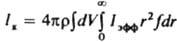 ,
,
где r и V - соотв. плотность твердой фазы и объем системы, сначала медленно растет (период индукции), затем резко увеличивается в результате одновременного возрастания r и f и, пройдя через максимум, уменьшается (рис. 3) вследствие снижения Iэфф. В периоды индукции и увеличения скорости кристаллизации в системе преобладают зарождение и рост кристаллов, в период уменьшения скорости - их рост, агрегация и раскалывание и далее -освальдово созревание и структурная перекристаллизация. Период индукции сокращается под влиянием факторов, к-рые ускоряют зародышеобразование и рост кристаллов. Так, при охлаждении расплавов этот период с повышением интенсивности охлаждения сначала уменьшается, а затем
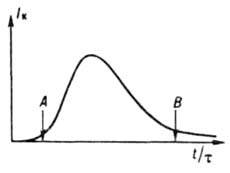
Рис. 3. Типичное изменение скорости периодической кристаллизации: t - время процесса; t - длительность периода индукции; A - момент появления новой фазы; В - начало стадии структурной перeкристаллизации и освальдова созревания.
возрастает из-за экстремальной зависимости скоростей зарождения и роста кристаллов от переохлаждения; если темп охлаждения достаточно велик, расплав твердеет, оставаясь аморфным (см. Стеклообразное состояние). Для сокращения периода индукции в систему добавляют кристаллы продукта (затравку), к-рые растут, что приводит к увеличению скорости кристаллизации. В результате выделения при росте кристаллов теплоты кристаллизации снижается переохлаждение и замедляется зародышеобразование. При малых переохлаждениях (пересыщениях) зародыши вообще не возникают, и затравка, введенная в систему в виде единичных кристаллов, может вырасти в монокристалл, а в виде порошка-в т. наз. монодисперсный продукт с узкой ф-цией f(r, t). При непрерывной кристаллизации ф-ция f(r,t) в сопоставимых условиях перемешивания шире, чем при периодич. кристаллизации, что объясняется разбросом времен пребывания кристаллов в кристаллизаторах непрерывного действия. Чтобы сузить эту ф-цию, режим кристаллизации приближают к режиму идеального вытеснения, чтобы расширить - к режиму идеального перемешивания (см. Структура потоков). При малом пересыщении системы непрерывная кристаллизация устойчива к флуктуациям внеш. условий; при высоком пересыщении его значение и размер кристаллов колеблются в ходе кристаллизации. В хим. и смежных отраслях пром-сти, а также в лабораториях преим. применяют кристаллизацию из расплавов и р-ров, реже - кристаллизацию из паровой и твердой фаз. Кристаллизацию из расплавов используют гл. обр. для отверждения расплавленных в-в и, кроме того, для их фракционного разделения и выращивания монокристаллов. Отверждение в-в в виде отливок (блоков) осуществляют в спец. формах. В малотоннажных произ-вах (напр., реактивов) обычно применяют отдельные формы определенных размеров или конфигурации, в к-рых расплав охлаждается путем естеств. теплообмена с окружающей средой; в крупнотоннажных произ-вах (нафталина и др.). Кристаллизацию проводят в секционированных, трубчатых, конвейерных и иных кристаллизаторах со встроенными формами, принудительно охлаждаемыми водой, жидким NH3, хладонами и т.п. Для получения продуктов в виде тонких пластинок или чешуек используют непрерывно действующие ленточные, вальцевые и дисковые кристаллизаторы, где отверждение происходит значительно интенсивнее, чем в формах. В ленточном кристаллизаторе (рис. 4) исходный расплав
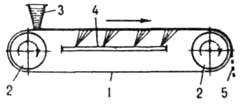
Рис. 4. Ленточный кристаллизатор: 1 лента; 2 приводные барабаны; 3 питающий бункер; 4 охлаждающее устройство; 5 отверждснный продукт.
тонким слоем подается на движущуюся металлич. ленту, на к-рой он охлаждается до полного затвердевания. В вальцевом аппарате (рис. 5) продукт кристаллизуется на наружной пов-сти охлаждаемого изнутри вращающегося полого барабана (вальца), частично погруженного в ванну с расплавом; кристаллы снимаются с барабана неподвижным ножом. В дисковых аппаратах отверждение продуктов происходит на пов-сти охлаждаемых изнутри вращающихся дисков.
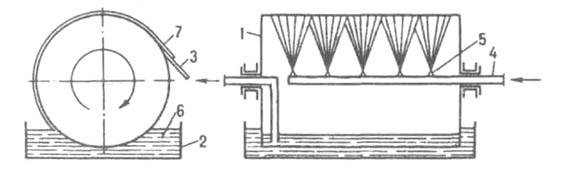
Рис. 5. Вальцевый кристаллизатор: 1 барабан; 2 ванна; 3 нож; 4 труба для подачи хладагента; 5 форсунка; 6 расплав; 7 отвержденный продукт.
При приготовлении гранулир. продуктов расплав диспергируют непосредственно в поток хладагента газообразного, в осн. воздуха (произ-во аммиачной селитры, карбамида и др.), или жидкого, напр. воды либо масла (произ-во пластмасс, серы и т. п.) в полых башнях или аппаратах с псевдоожнжeнным слоем, где кристаллизуются мелкие капли расплава (см. Гранулирование). Кристаллизацию из растворов используют преим. для выделения ценных компонентов из р-ров, а также их концентрированна (см. Вымораживание) и очистки в-в от примесей. В-ва, р-римость к-рых сильно зависит от т-ры (напр., KNO3 в воде), кристаллизуют охлаждением горячих р-ров, при этом исходное кол-во р-рителя, к-рый содержится в маточной жидкости, в системе не изменяется (изогидрическая кристаллизация). В малотоннажных произ-вах применяют емкостные кристаллизаторы периодич. действия, снабженные охлаждаемыми рубашками. В таких аппаратах р-р охлаждают при непрерывном перемешивании по определенной программе. Для предотвращения интенсивной инкрустации пов-стей охлаждения разность т-р между р-ром и хладагентом должна быть не более 8-10°С. В крупнотоннажных произ-вах используют, как правило, скребковые, шнековые, дисковые, барабанные и роторные кристаллизаторы непрерывного действия. Скребковые аппараты обычно состоят из неск. последовательно соединенных трубчатых секций, в каждой из к-рых имеется вал со скребками и к-рые снабжены общей или индивидуальными охлаждающими рубашками. При вращении вала скребки очищают внутр. пов-сть охлаждаемых труб от осевших на них кристаллов и способствуют транспортированию образовавшейся сгущенной суспензии из секции в секцию. В шнековых кристаллизаторах р-р перемешивают и перемещают с помощью сплошных или ленточных шнеков. Дисковые кристаллизаторы снабжены неподвижными либо вращающимися дисками. В первом случае (рис. 6) по оси аппарата расположен приводной вал со скребками для очистки пов-стей дисков от осаждающихся кристаллов; исходный р-р подается в кристаллизатор сверху, а образующаяся суспензия последовательно проходит в пространстве между охлаждаемыми дисками и выгружается через ниж. штуцер. Во втором случае вал с дисками размещен внутри корыта или горизонтального цилиндрич. сосуда; кристаллы снимаются с пов-сти дисков неподвижными скребками.
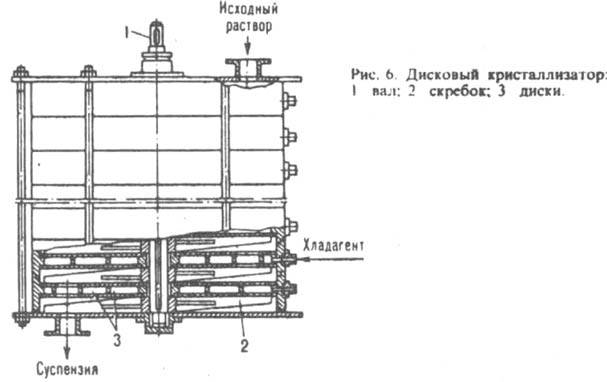
Осн. элемент барабанного кристаллизатора - полый барабан с опорными бандажами, установленный под углом 15° к горизонтальной оси и вращающийся с частотой 5-20 мин-1. Р-р, охлаждаемый водяной рубашкой или воздухом (к-рый нагнетают вентилятором через внутр. полость барабана), поступает с одного его конца, а суспензия отводится с другого. Вязкие р-ры (напр., жирных к-т) часто охлаждают в роторных кристаллизаторах - цилиндрич. аппаратах, внутри к-рых с большой скоростью вращается ротор с ножами. Последние под действием центробежной силы прижимаются к внутр. пов-сти кристаллизатора, очищая ее от осевших кристаллов. Р-р обычно подастся в аппарат под избыточным давлением. Для увеличения времени пребывания в кристаллизаторе р-ра и большего его переохлаждения последовательно соединяют неск. аппаратов. При использовании скребковых, шнековых, роторных и иногда дисковых кристаллизаторов часто образуются мелкие кристаллы (0,1-0,15 мм), что приводит к увеличению слеживаемости и адсорбц. загрязнения продукта, а также ухудшает его фильтруемость. Поэтому для укрупнения кристаллов продукта после упомянутых аппаратов устанавливают т. наз. кристаллорастворители, в к-рых концентрир. суспензия выдерживается при медленном охлаждении, что приводит к росту кристаллов до 2-3 мм. Для получения крупнокристаллич. однородных продуктов часто применяют кристаллизаторы с псевдоожиженным слоем (рис. 7). Исходный р-р вместе с циркулирующим осветленным маточником подается насосом в теплообменник, где в результате охлаждения р-р пересыщается и поступает по циркуляц. трубе в ниж. часть кристаллорастворителя, в к-ром кристаллы поддерживаются во взвешенном состоянии восходящим потоком р-ра. Кристаллизация происходит в осн. на готовых центрах кристаллизации, при этом крупные кристаллы осаждаются на дно аппарата, откуда удаляются в виде сгущенной суспензии. Осветленный маточник разделяется на две части: одна отводится из верх, части аппарата, другая подается на рециркуляцию.
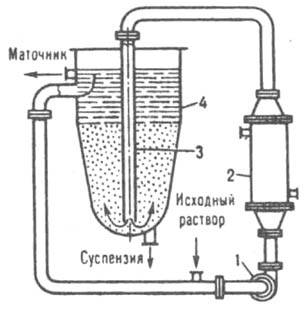
Рис. 7. Кристаллизатор с псевдоожиженмым слоем: I насос: 2 теплообмeнник: 3 циркуляционная труба; 4 кристаллорастворитель.
В ряде cлучаев кристаллизацию р-ров осуществляют непосредственным смешением их с жидкими, газообразными и испаряющимися хладагентами в смесительных, барботажных, распылительных и др. аппаратах. Если р-римость в-ва мало изменяется с изменением т-ры (напр., NaCl в воде), кристаллизацию проводят частичным или практически полным испарением р-ритeля путем выпаривания насыщ. р-ра при почти постоянной т-ре (изотермическая кристаллизация). По конструкции выпарные кристаллизаторы в значит. степени напоминают выпарные аппараты (см. Выпаривание) и могут иметь внутр. или выносную (рис. 8) греющие камеры. В таком кристаллизаторе исходный и циркулирующий р-ры, проходя через камеру, нагреваются до т-ры кипения. Образовавшаяся парожидкостная смесь поступает в сепаратор, где пар отделяется от р-ра. Кристаллы, осаждающиеся в сепараторе, вместе с маточной жидкостью направляются в спец. аппарат, в к-ром отделяются от нее и выводятся в виде конц. суспензии;
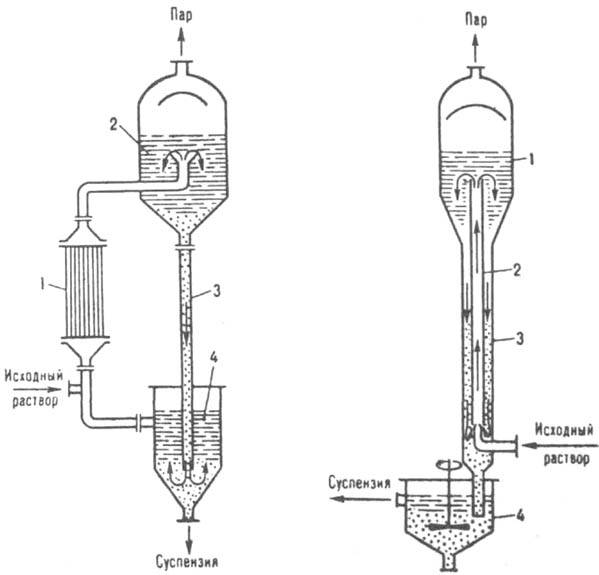
Рис. 8. Выпарной кристаллизатор: 1 выносная греющая камера: 2 сепаратор: 3 циркуляционная труба; 4 отделитель кристаллов.
Рис. 9. Вакуум-кристаллизатор: 1 - сепаратор: 2 - циркуляционная труба: 3 барометрическая труба; 4 гидрозатвор
осветленный маточник возвращается в камеру. Для предотвращения инкрустации (обрастания) пов-стей нагрева р-р должен циркулировать в кристаллизаторе с достаточно большой скоростью (до 3 м/с), что часто достигается применением осевых насосов. При одновременном охлаждении и выпаривании р-рителя кристаллизацию осуществляют в вакуум-кристаллизаторах периодич. или непрерывного действия, с принудительной либо естественной циркуляцией р-ра. Р-р охлаждается вследствие адиабатич. испарения части р-рителя при создании в таком аппарате определенного разрежения. Кол-во испаренного р-рителя обычно составляет 8-10% от общей массы р-ра. В кристаллизаторе с естеств. циркуляцией (рис. 9) исходный р-р подается в ниж. часть циркуляц. трубы и вместе с циркулирующей суспензией поднимается вверх, где в результате понижения давления вскипает. Образовавшиеся пары проходят через сепаратор и поступают в барометрич. конденсатор. Пересыщенный р-р и выделившиеся кристаллы движутся вниз по барометрич. трубе, откуда кристаллы вместе с частью маточной жидкости выводятся в гидрозатвор. Для поддержания разрежения используют вакуум-насосы или пароструйные инжекторы. В крупнотоннажных произ-вах широко распространены многокорпусные вакуум-кристаллизац. установки с числом корпусов 4-24, в к-рых глубина разрежения постепенно возрастает от первого корпуса к последнему. Вакуум-кристаллизаторы более производительны и экономичны, чем выпарные кристаллизаторы. Кристаллизацию нек-рых в-в можно осуществить высаливанием. При выделении неорг. соед. используют орг. в-ва (напр., Na2SO4 кристаллизуют, добавляя к его водному р-ру метанол, этанол либо NH3) или содержащие одинаковый ион с выделяемым соед. (напр., FeSO4 кристаллизуют из травильных р-ров добавкой конц. H2SO4); при выделении орг. соединений - воду, водные р-ры неорг. солей и т. п. Введение в р-р в качестве высаливателей орг. в-в обычно удорожает процесс из-за сложности их регенерации. Кристаллизация из паровой фазы позволяет кристаллизовать в-ва, обладающие высоким парциальным давлением паров над твердой фазой и способные непосредственно переходить из газообразного состояния в кристаллическое (напр., иод, фталевый ангидрид). Такую кристаллизацию используют для выделения ценных компонентов из парогазовых смесей, получения аэрозолей, нанесения тонких кристаллич. слоев на пов-сть разл. тел (напр., в произ-ве полупроводниковых материалов) и т.д. Кристаллизацию аморфной твердой фазы и рекристаллизацию осуществляют, как правило, при т-рах, близких к т-рам плавления кристаллизуемых в-в. При этом в результате термодиффузионных процессов изменяется первичная кристаллич. структура в-ва либо происходят зарождение и рост кристаллов из аморфной фазы. Такую кристаллизацию применяют для получения в-в и материалов с заданными кристаллич. структурой либо степенью кристалличности (термопластичные полимеры, стекло и др.). Литература
