Хладоны
ХЛАДОНЫ (фреоны), насыщ. фторуглероды или полифторуглеводороды (часто содержат также атомы С1, реже - Вr).
Торговые названия хладонов состоят из фирменного названия (в России - хладон, в США - фреон, по международному стандарту - буква R) и цифрового обозначения, в к-ром первая цифра - число атомов С минус единица (для соед. метанового ряда эта цифра опускается), вторая - число атомов Н плюс единица, третья - число атомов F (если число атомов F больше 9, то ставится дефис и далее цифра, указывающая на число атомов F в молекуле), напр. дифторхлорметан CHF2C1 наз. хладоном 22, декафторбутан C4Fig - хладоном 31-10. Для хладонов, содержащих атомы Вr, ставится буква В и цифра, показывающая число атомов Вr, напр. дифторхлорбромметан CF2ClBr наз. хладоном 12В1. Для циклич. хладонов перед цифровым обозначением ставится буква С, напр. перфторциклобутан наз. хладоном С318. При наличии изомеров цифровое обозначение соответствует наиб. симметричному соед. (наименьшая разность масс левой и правой частей молекулы), а у последующих, все более несимметричных, добавляются буквы а, b, с и т. д., напр. 1,1,1-трифторэтан наз. хладоном 143а. При наличии двойной связи в молекуле хладона в качестве четвертой цифры используют единицу.
Хладоны- газообразные или жидкие в-ва (табл.), раств. в орг. р-рителях, плохо или практически не раств. в воде; нек-рые хладоны образуют кристаллогидраты.
Хладоны- относительно инертны, их хим. превращения требуют высоких т-р. Пиролиз ряда хладонов при 600-1150 °С приводит к фторолефинам, фторпарафинам, галогенам или галогеноводородам (если хладон содержит атомы Н), напр.:
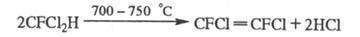
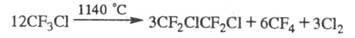
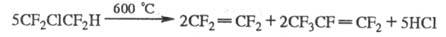
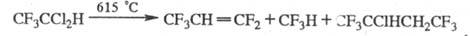
При УФ облучении в присут. О2 хладоны разрушаются с образованием радикалов, к-рые диспропорционируют до фторкарбонильных соед., фторолефинов, галогенов и др. Хлорсодержащие хладоны при УФ облучении выделяют атомарный хлор, к-рый взаимод. с молекулами озона:
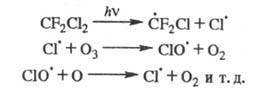
В стратосфере это приводит к снижению концентрации озона (т. наз. озоновые дыры).
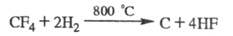
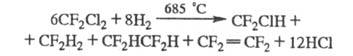
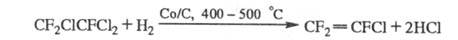
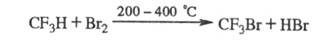
При взаимод. хладонов с F2 образуется, как правило, смесь продуктов фторирования. Хладоны, содержащие С1 или Вr, замещают их на F при р-ции с HF в присут. катализаторов, напр.:
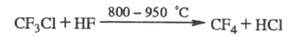
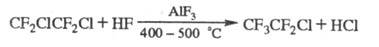
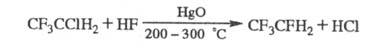
Бромсодержащие хладоны склонны к термич. распаду, могут ингибировать цепные радикальные процессы (окисление и др.).
Осн. пром. методы получения хладонов- жидко- или газофазное фторирование хлор- или бромпарафинов фтором, фторидами металлов или безводным HF в присут. галогенидов Sb; диспропорционирование полифторхлоралканов при 150-250 °С в присут. А12О3 или А1С13; хлорирование либо бромирование фторуглеводородов при 500-600 С:
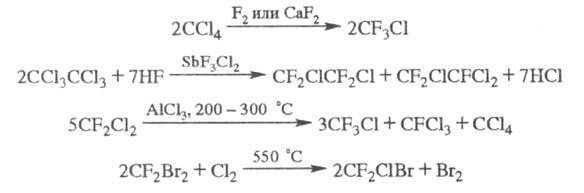
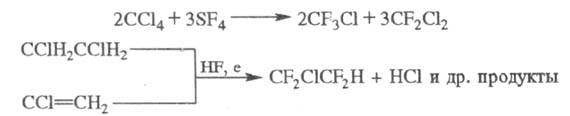
Хладоны могут быть получены также фторированием алканов или алкилгалогенидов SF4 либо электрохим. фторированием алкилгалогенидов или алкенилгалогенидов, напр.:
Хладоны- рабочие тела в пром. и бытовых холодильных агрегатах и кондиционерах; пропелленты для аэрозолей; порообразователи при произ-ве пенопластов и пенополиуретанов; инертные р-рители; реагенты для сухого травления при изготовлении интегральных схем; чистящие средства. Нек-рые хладоны применяют для синтеза фтормономеров и др. орг. продуктов. Бромсодержащие хладоны используют в огнетушащих составах в качестве ингибиторов пламени и флегматизаторов горения углеводородов.
В связи с влиянием на стратосферный озон (хладоны обнаружены на высоте 15-30 км от пов-сти Земли) пром. применение хладонов уменьшается. В 1985 была подписана Венская конвенция по защите озонового слоя, а в 1987 в Монреале принят Протокол, подписанный всеми основными странами, производящими хладоны, в к-ром определен перечень озоноактивных хладонов и намечены сроки обязат. сокращения объемов их произ-ва. Это хладоны 11, 12, 113, 114, 115, 12В1, 13В1, 114В2. Согласно дополнению, внесенному в монреальский Протокол в июне 1990, предписывается снизить произ-во указанных хладонов к 1995 на 50%, к 1997 на 85% и к 2000 прекратить совсем. Ввиду этого ведутся разработки новых, экологически безопасных хладонов (типа 123, 134 и др.), обладающих необходимыми эксплуатац. св-вами и легко разрушающихся в атмосфере с образованием малоактивных в-в.
Большинство хладонов- малотоксичны (нек-рые раздражают слизистые оболочки глаз и верхних дыхат. путей). Вдыхание воздуха с большими концентрациями хладонов может привести к отеку легких. ПДК 1000-3000 мг/м3. Особенно опасно воздействие продуктов разложения нек-рых хладонов на горячих пов-стях или в пламени (могут содержать фосген, НС1, HF, COF2 и др.). Для большинства хладонов т. самовоспл. выше 600 °С. Мировое произ-во хладонов ок. 900 тыс. т в год (1988).
СВОЙСТВА ХЛАДОНОВ
| Соединение | Мол. м. | Т. пл., оС | Т. кип., °С | 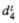 (°С) (°С) | 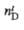 (°С) (°С) | tкрит°С | dкрит кг/м3 | ркрит МПа | 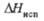 при т. кип., кДж/моль | cv, кДж/(кгК) | Давление пара, МПа (20 oC) | |
| Хладон 11 CFC13 | 137,37 | -110,45 | 23,65 | 1,476 (25) | 1,3824 (20) | 198,0 | 570,2 | 4,370 | 24,97 | 0,872 | 0,0889 | |
| Хладон 12 CF2C12 | 120,91 | -155,95 | -29,74 | 1,442 (-15) | 1,2950 (20) | 112,0 | 579,1 | 4,119 | 20,01 | 0,972 | 0,5665 | |
| Хладон 12В1 CF2ClBr | 165,36 | -159,5 | -4,0 | 1,880 (21) | 153,7 | 741,0 | 4,252 | 22,26 | — | 0,2345 | ||
| Хладон 12В2 CF2Br2 | 209,82 | -141,1 | 24,2 | 2,288 (15) | 1,399 (12) | 198,85 | 866,4 | 4,335 | 24,86 | 1,034 | 0,0850 | |
| Хладон 13 CF3C1 | 104,46 | -181,0 | -81,5 | 1,298 (-30) | 1,1990 (-73,3) | 28,8 | 582,4 | 3,878 | 15,43 | 0,851 | 3,186 | |
| Хладон 13В1 CF3Br | 148,91 | -174,7 | -57,8 | 1,538 (25) | 1,238 (25) | 66,9 | 770,0 | 3,946 | 17,62 | 0,872 | 1,430 | |
| Хладон 14 CF4 | 88,00 | -183,6 | -128,0 | 1,638 (-133) | 1,151 (-73,3) | -45,65 | 625,0 | 3,745 | 11,76 | 1,231 | — | |
| Хладон 21 CHFC12 | 102,92 | -127,0 | 8,7 | 1,4256 (25) | 1,3602 (25) | 178,5 | 528,0 | 5,190 | 24,61 | 1,073 | 0,1531 | |
| Хладон 22 CHF2C1 | 86,47 | -157,4 | -40,85 | 1,4909 (-69) | 1,2670 (20) | 96,13 | 512,8 | 4,986 | 20,19 | 1,110 | 0,9097 | |
| Хладон 23 CHF3 | 70,01 | -155,15 | -82,2 | — | 1,215 (-73,3) | 25,85 | 525,0 | 4,82 | 16,75 | — | 4,193 | |
| Хладон 112 CF2C12CFC12 | 203,83 | 26,0 | 92,8 | 1,634 (30) | 1,4115 (26) | 285,5 | 550,0 | 3,51 | 30,88 | — | 0,0236* | |
| Хладон 112а СF2С1ССl3 | 203,83 | 40,5 | 92 | 1,649 (20) | 278,0 | 573,0 | 3,34 | 30,57 | — | 0,0240* | ||
| Хладон 113 CF2ClCFCl2 | 187,38 | -36,6 | 47,5 | 1,582 (20) | 1,3588 (20) | 214,3 | 574,5 | 3,406 | 26,81 | 0,947 | 0,0364 | |
| Хладон 114 CF2C1CF2C1 | 170,92 | -94 | 3,55 | 1,470 (20) | 1,2865 (25) | 145,7 | 580,0 | 3,27 | 22,91 | 0,927 | 0,1834 | |
| Хладон 114В2 CF2BrCF2Br | 259,82 | -110,5 | 47,5 | 2,18 (20) | 1,3708 (20) | 214,15 | 790 | 3,358 | 2.6,66 | — | 0,0370 | |
| Хладон 115 CF3CF2C1 | 154,47 | -106 | -38,97 | *,6914 (-76) | 1,2678 (-42,2) | 80,0 | 592,3 | 3,123 | 19,41 | — | 0,7909 | |
| Хладон 123 CF3CHC12 | -152,93 | -107 | 27,1 | 1,475 (15) | 1,3332 (15) | 182,0 | 533 | 3,56 | 25,59 | — | 0,0778 | |
| Хладон 124а CF2C1CHF2 | 136,48 | -117 | -12,0 | 126,7 | 521 | 3,47 | 21,59 | — | 0,3154 | |||
| Хладон 134 CF2HCHF2 | 102,03 | — | -22,5 | — | — | 110,25 | 477 | 3,77 | — | — | 0,4737 | |
| Хладон 142в CF2ClCH3 | 100,49 | -130,8 | -9,2 | 1,120 (25) | — | 136,45 | 459,0 | 4,138 | 22,57 | — | 0,2904 | |
| Хладон 143а CF3CH3 | 84,04 | -111,3 | -47,6 | 0,924 (30) | — | 73,1 | 445 | 4,11 | 19,88 | — | 1,187 | |
| Хладон 152а CHF2CH3 | 66,05 | -117 | -24,55 | 1,004 (-25) | 1,3011 (-72) | 113,5 | 365,0 | 4,491 | 21,88 | — | 0,5267 | |
| Хладон 218 CF3CF2CF3 | 188,02 | -148,3 | -36,8 | 1,350 (20) | — | 71,9 | 628 | 2,677 | 20,26 | — | 0,7631 | |
| Хладон С318 CF2(CF2)2CF2 | 200,03 | -41,4 | 6,0 | 1,5341 (20) | 1,217 (25) | 115,22 | 616 | 2,778 | 22,31 | — | 0,2655 |
*При 50 °С
Лит.: Исикава Н., Кобаяси Ё., Фтор. Химия и применение, пер. с япон., М., 1982; Новое в технологии соединений фтора, под ред. Н. Исикава, пер. с япон., М., 1984; Промышленные фторорганические продукты. Справочник, Л., 1990.
И. И. Крылов.
