Фтор
ФТОР (от греч. phthoros - разрушение; лат. Fluorum) F, хим. элементVП гр. периодич. системы, относится к галогенам; ат. н. 9, ат. м. 18,998403. Прир. фтор состоит из одного стабильного нуклида 19F. Поперечное сечение захвата тепловых нейтронов 1 ·10-31 м2. Конфигурация внеш. электронной оболочки атома 2s22p5 степень окисления -1; энергии ионизации при последоват. переходе от F0 к P7+ соотв. равны 1681, 3375, 6046, 8409, 11024, 15164 и 17868 кДж/моль; сродство к электрону 327,8 кДж/моль. Фтор- самый электроотрицат. элемент, его электроотрицательность по Полингу 3,98. Ионный радиус F (в скобках даны координац. числа): 0,115 нм (2), 0,116 нм (3), 0,117 нм (4) и 0,119 нм (6). Ядро атома 19F имеет спин 1/2 и близкое к свойственному для протия гиромагн. отношение, что позволяет получать спектры ЯМР с высоким разрешением.
Молекула своб. фтора двухатомна, межатомное расстояние 0,14165 нм. F2 имеет аномально низкую (по сравнению с ожидаемой) в ряду галогенов энергию диссоциации (158 кДж/моль).
Содержание фтора в земной коре 0,065% по массе. Встречается только в связанном состоянии. Осн. минерал, имеющий пром. значение,- флюорит (плавиковый шпат) CaF2, месторождения к-рого встречаются на всех континентах, а наиб. запасы сосредоточены в США, Мексике, Великобритании, Италии, ЮАР, Таиланде, Монголии, КНР. Общее содержание фтора в пром. рудах CaF2 122, в перспективных - 236 млн. т (1984, без СССР). В СНГ залежи флюорита имеются в Узбекистане, Таджикистане, Казахстане, в Забайкалье, Приморском крае и др.
К редким фторсодержащим минералам относятся криолит Na3AlF6, хиолит 5NaF·3AlF3, селлаит MgF2, иттрофлюорит Ca1-xYxF2-x. Изоморфно замещая ионы ОН-, О2- и др., фтор входит также в состав мн. минералов, напр. топаза Al2SiO4(OH, F)2, амблигонита LiAlPO4(OH, F), бастнезита (Ce, La)CO3F, апатита Ca5(PO4)3(OH, F), слюд и гидросиликатов. Наиб. пром. значение помимо флюоритовых руд имеют апатит и фосфориты, из к-рых фтор получают в виде хим. соед.; они содержат не более 3,5-4,2% фтора по массе, но добываются в больших кол-вах для произ-ва соед. фосфора. Запасы фтора в фосфатных рудах СНГ в 5 раз превышают его запасы во флюоритовых рудах (1988). Соед. фтора содержатся во мн. подземных водах.
В небольших кол-вах фтор входит в состав живых организмов (в организме человека 2,6 г фтора, из них 2,5 г - в костях), участвует в процессах образования зубов и костей, в обмене в-в и в активации нек-рых ферментов. Нормальное поступление фтора в организм человека 2,5-3,5 мг в сут. Пониженные и повышенные кол-ва фтора вызывают разл. заболевания.
Свойства. Фтор- бесцв. газ с сильным запахом, напоминающим запах хлора; т. кип. -188,20 0C, т. пл. -219,70 0C; плотн. газа 1,693 кг/м3 (О 0C, 0,1 МПа), жидкости 1516 кг/м3 (-188 0C); .tкрит -128,84 0C, pкрит 5,215 МПа, dкрит 0,574 г/см3; давление в тройной точке 252 Па; 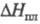 0,5104 кДж/моль,
0,5104 кДж/моль,  6,544 кДж/моль; C0p 31,34 Дж/(моль·К);
6,544 кДж/моль; C0p 31,34 Дж/(моль·К); 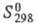 202,68 Дж/(моль· К); теплопроводность газообразного фтора с точностью до 10% совпадает с теплопроводностью N2; коэф. самодиффузии при 0 0C и атм. давлении 0,170 см2/с.
202,68 Дж/(моль· К); теплопроводность газообразного фтора с точностью до 10% совпадает с теплопроводностью N2; коэф. самодиффузии при 0 0C и атм. давлении 0,170 см2/с.
В твердом состоянии при обычном давлении фтор образует две кристаллич. модификации: ниже -227,60 0C 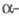 форму с моноклинной решеткой (плотн. 1,97 г/см3 при -250 С), выше -
форму с моноклинной решеткой (плотн. 1,97 г/см3 при -250 С), выше - 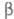 -форму с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
-форму с кубич. решеткой (а = 0,667 нм, плотн. 1,70 г/см3).
Плотн. жидкого фтора описывается ур-нием d= 1,907-2,20- 10-3T-2,948·10-5T2 г/см3 (67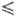 T
T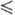 103 К); вязкость - ур-нием
103 К); вязкость - ур-нием 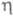 = 2,43 · 10-7ехр( 196/T)Па ·с; ур-ние температурной зависимости давления пара над жидким фтором 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2 - 1,34590196X3 + + 2,71138936X(1-X)1,4327, где X = (1 - Ттр/T)/(1 - Ттр/Ткрит; Tтр и pтр - соотв. т-ра и давление в тройной точке; Ткрит -критич. т-ра; g жидкого фтора 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К);
= 2,43 · 10-7ехр( 196/T)Па ·с; ур-ние температурной зависимости давления пара над жидким фтором 1n(р/ртрПа) = 7,89592346Х+3,38765063Х2 - 1,34590196X3 + + 2,71138936X(1-X)1,4327, где X = (1 - Ттр/T)/(1 - Ттр/Ткрит; Tтр и pтр - соотв. т-ра и давление в тройной точке; Ткрит -критич. т-ра; g жидкого фтора 0,0179 Н/м (69,2 К) и 0,0146 Н/м (81,0 К); 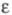 1,4577 (70,0 К) и 1,2073 (143,0 К).
1,4577 (70,0 К) и 1,2073 (143,0 К).
Фтор раств. в нек-рых фторидах, хлор- и фторуглеродах. Жидкий фтор неограниченно смешивается с жидкими O2 и O3. С водой энергично реагирует: 2F2 + 2H2O 4HF + O2. Не образует кислородных к-т, с H2 бурно реагирует, давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
4HF + O2. Не образует кислородных к-т, с H2 бурно реагирует, давая фтористый водород. Для орг. соед. известны фторноватистой кислоты эфиры.
Фтор- один из сильнейших окислителей и фторирующих реагентов. Благодаря высокой энергии связи элемент — фтор во фторидах и низкой энергии диссоциации F2 многие р-ции фторирования простых в-в, оксидов, галогенидов и др. соед. необратимы, сопровождаются выделением большого кол-ва тепла и образованием фторидов элементов в высш. степенях окисления. Все хим. элементы, за исключением Не, Ne и Ar, образуют устойчивые фториды.
В то же время по кинетике взаимод. с фтором поведение в-в может сильно отличаться. Многие р-ции имеют цепной характер, самопроизвольно инициируются при комнатной или более низкой т-ре и протекают со вспышкой или со взрывом, а в потоке - с возникновением пламени. К таким р-циям относится фторирование H2 и водородсодержащих в-в (углеводородов, H2O, NH3, N2H4, HCl, HBr, HCN и др.), S и ее производных (SO2, SOCl2, S4N4, SBr2 и др.), Si, P и др. Теоретич. т-ра горения стехиометрич. смеси с H2 4430 К. При комнатной т-ре с фтором способны реагировать щелочные металлы, нек-рые галогениды, гидраты солей. В то же время р-ции F2 с большей частью простых в-в и неорг. соед. протекают лишь при их активации, достигаемой обычно повышением т-ры или давления. На величину т-ры начала фгорирования влияют природа в-в, дисперсность твердых в-в, св-ва продуктов р-ции (нелетучие фториды могут экранировать пов-сть, замедлять и даже прекращать фторирование), условия процесса (парциальное давление F2, интенсивность теплоотвода и др.). Р-ция F2 с Ag, V, Re, Os начинается при 100-250 0C, с Au, Cd, Ti, Zr, Nb, Та, Cr, W, Mn, Со - при 300-350 0C, а с Al, Fe, Cu, Zn, Y, Ni (на пов-сти к-рых образуется пленка нелетучих фторидов) - лишь ок. 400-500 0C. Температурный интервал "спокойного", регулируемого фгорирования, однако, невелик, и при избытке F2 многие р-ции переходят при превышении нек-рой т-ры в горение. Особое место занимает фгорирование графита, сопровождающееся образованием при т-рах ниже 400 0C фторидов графита CFx (см. Графита соединения).
Оксиды металлов и многие соли неск. более устойчивы к действию F2, чем сами металлы. Взаимод. оксидов может сопровождаться образованием на промежут. стадиях окси-фторидов.
Наиб. устойчивы к действию F2 благородные газы, N2, O2, алмаз, нек-рые виды стеклоуглерода, СО, CO2, сапфир и алунд.
Одним из путей снижения т-ры фгорирования является применение катализаторов. Активация F2 м. б. проведена также его атомизацией и ионизацией в газовых разрядах, электронном пучке, под действием УФ облучения и термока-талитически (на нагретой пов-сти катализатора). Атомный F при комнатной т-ре и в криогенных условиях взаимод. с Xe,
Kr, СО, NOF, NO2, O2, ClF3 и мн. др. в-вами. См. также Фторирование.
Наиб. важным соед. фтора посвящены отдельные статьи: Азота фториды, Бора трифторид, Галогенфториды, Кислорода фториды, Кремния фториды, Фтористоводородная кислота, Фтористый водород, Фторобораты, Фторорганические соединения, Фторосиликаты и др.
Получение. Общая схема произ-ва своб. фтора включает добычу и обогащение флюоритовых руд, серно-кислотное разложение флюоритовых концентратов, выделение и очистку безводного HF, его электролитич. разложение. Ведущие производители флюоритовых концентратов - Мексика (20-25% мирового произ-ва), ЮАР, Монголия, КНР, Таиланд, Франция, Испания. Общий мировой объем их произ-ва 4-5 млн. т в год.
Электролитич. разложение HF м. б. осуществлено 3 способами: низкотемпературным (15-50 0C, в смеси HF с KF), среднетемпературным (70-120 0C, расплав KH2F3) и высокотемпературным (245-310 0C, расплав KHF2). В пром-сти используют среднетемпературный способ. Стандартный потенциал разложения HF в расплаве KH2F3 равен 2,9 В. Пром. электролизеры работают обычно при 80-105 0C, напряжении 8,5-12,0 В и анодной плотности тока 70-180 мА/см2. Их мощность по току достигает 11 кА, опытных образцов -15 кА, что соответствует производительности 7-10 кг Р2/ч.
Электролизеры представляют собой стальные или монеле-вые ванны с размещенными на крышке угольными анодами и расположенными между анодами стальными катодами. В нек-рых конструкциях между катодами и анодами имеются перфорированные диафрагмы, предотвращающие смешивание и взаимод. выделяющихся F2 и H2. Совр. электролизеры снабжены системами непрерывной подачи в них HF, поддержания постоянной т-ры, отвода H2 и F2. Отбор F2 проводят с помощью спец. коробчатых сборников, "колоколов", расположенных на крышке и погруженных в расплав так, что они окружают верх. часть анодов. При электролизе на пов-сти угольных анодов образуется пассивирующий слой фторидов графита CFx, что вызывает "анодный эффект" - резкое повышение напряжения и его скачки. Этот эффект подавляют введением в электролит добавок, использованием анодов особой конструкции и пульсирующего тока. Свежезагружаемый электролит тщательно обезвоживают, проводя электролиз примеси влаги при низком напряжении. Для снижения т-ры процесса разрабатывают электролиз смеси KH2F3 - NH4HF2 - HF.
Очищают фтор методами селективной сорбции примесей (HF на гранулированном пористом NaF), вымораживания примесей, сжижения фтора, хим. и фотохим. связывания примесей. Глубокую очистку фтора проводят с помощью низкотемпературной ректификации или его обратимой хемосорбцией (напр., путем образования и термич. разложения K2NiF4).
Для получения своб. фтора в лабораториях или в портативных установках могут использоваться его твердые источники. Так, MnF4 при нагр. до 200 0C выделяет ок. 15% F2 от своей начальной массы. Взаимод. K2MnF6 и SbF5 протекает с выделением KSbF6, MnF3 и F2. Разработаны пиротехн. источники F2, содержащие соли тетрафтораммония.
Определение. Осн. метод определения фтора в р-рах - потен-циометрия с использованием спец. селективных электродов. Чувствит. элемент таких электродов (мембрану) чаще всего изготовляют из монокристаллич. LaF3, легированного дифто-ридами др. металлов. Кроме того, применяют гравиметрич. или объемный методы, основанные на осаждении труднорастворимых PbClF, CaF2, ThF4 и др.
Наиб, универсальный метод разложения мн. твердых неорг. фторидов - пирогидролиз. Образующийся HF поглощают водными р-рами и анализируют объемным или потенциометрич. методами. Применяют также отгонку с парами H2O и улавливание в виде H2SiF6, разл. физ. методы.
Свободный фтор в газах определяют потенциометрически, поглощением его твердым NaCl и последующим определением выделившегося Cl2 иодометрически, поглощением его ртутью и волюмометрич. определением. Фторорг. в-ва предварительно разлагают натрием. Качественно фтор обнаруживают по вьщелению HF, а также методами количеств, анализа.
Применение. Своб. фтор - фторирующий реагент в произ-ве UF6 (см. Урана фториды), галогенфторидов, SF4, SF6, BF3, фторидов азота, фторидов графита, высш. фторидов металлов (WF6, MoF6, ReF6), фторидов благородных газов, фторорг. производных и др. Атомный фтор используют в хим. лазерах на HF и DF, для синтеза KrF2, кислорода фторидов и др.
Фтор сильно токсичен. Раздражает кожу, слизистые оболочки носа и глаз; непереносимая концентрация 77 мг/м3. Вызывает дерматиты, конъюнктивиты, отек легких. Контакт с чистым фтором приводит к ожогу. Хронич. отравление соед. фтора вызывает флюороз. ПДК 0,03 мг/м3 - в воздухе производств. помещений, 0,7 мг/л - в воде (для фторид-иона).
Сжиженный фтор перевозят в охлаждаемых цистернах и хранят в танках.
Мощности по произ-ву своб. фтора в развитых странах достигают 15-20 тыс. т в год.
Фтор открыт К. Шееле в 1771, в свободном виде получен А. Муассаном в 1886.
Лит.: Раков Э.Г., Химия и технологах неорганических фторидов, M., 1990; Gmelins handbook of inorganic chemistry, system. № 5. F. Fluorine. Suppl. v. 2. The element, B., 1980. Э.Г. Раков.
